Jod występuje w postaci cząsteczek dwuatomowych – I2. W warunkach standardowych (oraz normalnych) jest to ciało stałe barwy fioletowej. Brom, czyli pierwiastek leżący w tej samej grupie bezpośrednio nad jodem jest cieczą, a flor i chlor to gazy. Stopniowa zmiana stanu skupienia kolejnych fluorowców wynika nie tylko ze wzrastającej masy cząsteczkowej. Za stały stan skupienia jodu odpowiadają głównie stosunkowo silne oddziaływania międzycząsteczkowe typu dipol indukowany – dipol indukowany. Wszystkie cząsteczki dwuatomowe zbudowane z dwóch takich samych atomów (tzw. homoatomowe) są niepolarne. Jednak duże chmury elektronowe atomów jodu mogą łatwo przemieszczać się względem jąder atomowych, a tym samym cząsteczki uzyskują chwilowy moment dipolowy (indukowany moment dipolowy).
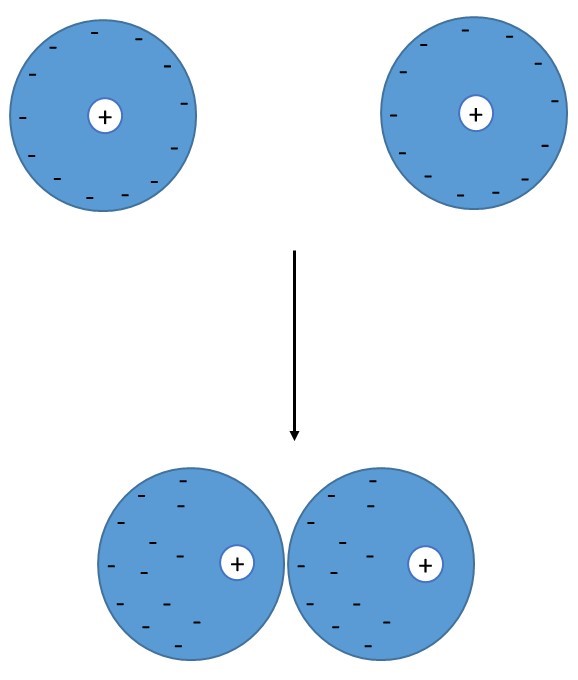
Rysunek 1. Schemat tworzenia się dipoli indukowanych.
Oddziaływanie między powstałymi dipolami odpowiadają za stały stan skupienia jodu. Oddziaływania te nie są jednak zbyt mocne, do zniszczenia sieci krystalicznej jodu wystarczy już temperatura 114 oC.
Dość często można spotkać się ze stwierdzeniem, że jod pod ciśnieniem atmosferycznym nie ulega stopieniu, a podczas ogrzewania zachodzi proces sublimacji, podobnie jak dla CO2. Niestety w przypadku jodu nie jest to prawda, co można zobaczyć na poniższym diagramie fazowym.
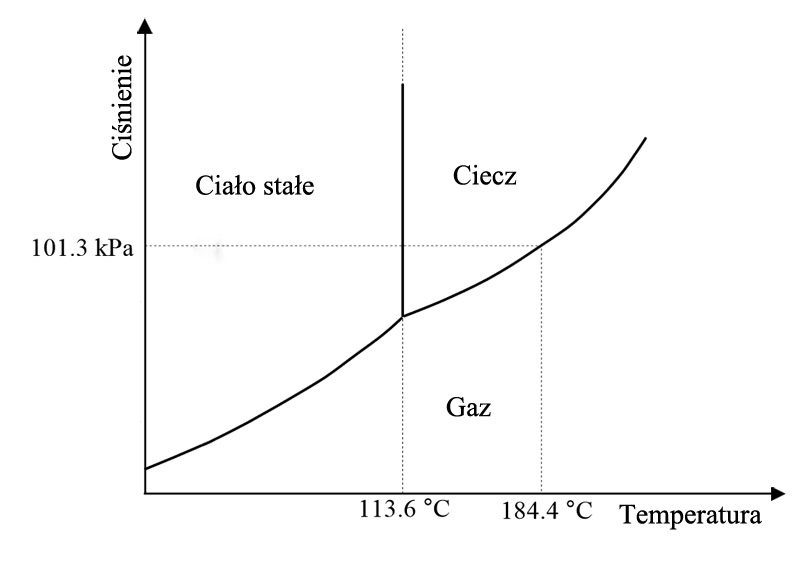
Rysunek 2. Diagram fazowy jodu.
Jak widzimy ogrzewanie stałego jodu pod ciśnieniem 101,3 kPa (1 atm) prowadzi najpierw do przejścia w fazę ciekłą (temp. topnienia 113,6 oC), a dopiero w temp. 184,4 oC w gaz.
Podczas naszego doświadczenia jod reaguje z magnezem zgodnie z równaniem:
Mg + I2 → MgI2
Proces ten jest egzotermiczny, wydzielone ciepło powoduje stopienie oraz wrzenie jodu. Powstały jodek magnezu to ciało stałe barwy białej. Jest to substancja nietrwała, rozkłada się już w temperaturze pokojowej. W obecności powietrza zachodzi również reakcja z tlenem prowadząca do wydzielenia jodu:
2MgI2 + O2 → 2MgO + 2I2
Jod jest niezbędny w naszym organizmie do prawidłowego działania tarczycy. Należy jednak pamiętać, że jest to zarazem substancja trująca, dawka śmiertelna dla dorosłego człowieka to około 4 g jodu.
UWAGA! Substancje niebezpieczne: