Fazą termodynamiczną nazywamy fragment układu o jednolitych właściwościach fizycznych. Dla substancji chemicznych fazę możemy utożsamiać ze stanem skupienia. Standardowo wyróżniamy trzy stany skupienia: gaz, ciecz i ciało stałe, choć poza typowymi fazami istnieje jeszcze plazma, szkło rotacyjne, fazy ciekłokrystaliczne i inne (Atkins, 2007).
Substancja może istnieć w danej fazie w pewnym zakresie ciśnienia i temperatury. Przemiany pomiędzy fazami mogą zatem zachodzić pod wpływem zmian temperatury i ciśnienia. Zakresy tych parametrów w których różne fazy są termodynamicznie trwałe oraz parametry przemian fazowych obrazuje diagram fazowy (Atkins, 2007). Na diagramie obszary równowagi pomiędzy dwoma fazami widoczne są jako linie. W miejscu przecięcia linii znajduje się tak zwany punkt potrójny. W temperaturze i ciśnieniu określonym przez ten punkt wszystkie trzy stany skupienia są w równowadze przez co możemy zaobserwować wrzenie i krzepnięcie substancji w tym samym czasie. Poniżej przedstawiamy diagram fazowy azotu.
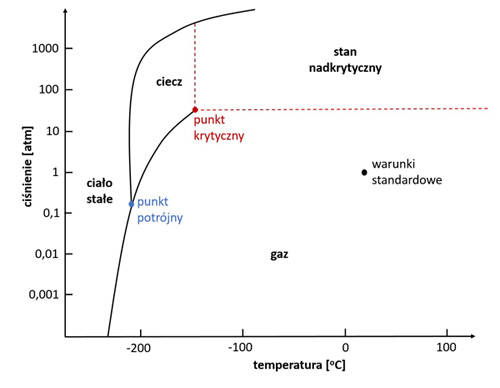 Rys. 1. Diagram fazowy azotu (www.wolframalpha.com)
Rys. 1. Diagram fazowy azotu (www.wolframalpha.com)
Na diagramie widoczny jest również punkt krytyczny. Punkt ten określa temperaturę krytyczną, czyli temperaturę powyżej której nie da się skroplić substancji, niezależnie od wartości ciśnienia.
Celem naszego doświadczenia było pokazanie właściwości substancji w punkcie potrójnym. W pierwszym przypadku wykorzystaliśmy 2-metyloproan-ol (alkohol tert-butylowy). Dzięki pompie próżniowej o wysokiej wydajności gwałtownie obniżyliśmy ciśnienie w kolcie. Alkohol prawie natychmiast zaczął wrzeć. Po chwili wrzenie ustało, a ciecz zaczęła zamarzać. W tym momencie wyłączyliśmy pompę. Układ dąży do osiągnięcia równowagi między powstałym ciałem stałym, cieczą i znajdującym się w kolbie gazem. Ponieważ pompa usunęła większość gazu z kolby, układ dąży do zwiększenia ilości gazu i zaczyna gwałtownie wrzeć.
W podobny sposób można spowodować zamarznięcie ciekłego azotu. Również w tym przypadku udało nam się doprowadzić układ do stanu w którym ciekły azot jednocześnie zamarza i wrze. Ponieważ temperatura punktu potrójnego dla azotu to -210 oC, (dla alkoholu tert-butylowego ok. 25 oC) (The National Institute of Standards and Technology (NIST)) po wyłączeniu pompy azot bardzo szybko paruje podnosząc ciśnienie w układzie i stały azot szybko się topi.
Dziękujemy doktorowi Pawłowi Stelmachowskiemu z Grupy Chemii Powierzchni i Materiałów WCh UJ za użyczenie pompy próżniowej.
Literatura:
Atkins, P. W. (2007). Chamia fizyczna. Warszawa: Wydawnictwo Naukowe PWN.
NIST: http://webbook.nist.gov/cgi/cbook.cgi?ID=C75650&Mask=4 dostęp online z dn. 29.10.2015.