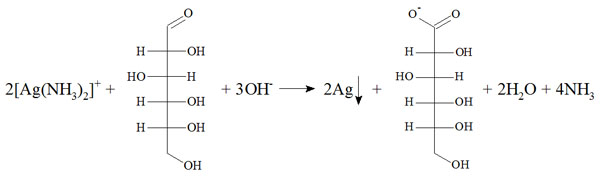
Szkło wodne, czyli nasycony roztwór krzemianu sodu, to gęsta (syropowata) bezbarwna ciecz, którą można otrzymać w wyniku rozpuszczania stopionego SiO2 i Na2CO3. Znajduje zastosowanie jako klej mineralny, środek do impregnowania drewna, przy produkcji detergentów jak również przy produkcji żywic silikonowych (Bielański, 2010).
W podwyższonej temperaturze, podczas stapiania SiO2 i Na2CO3 wiele wiązań Si—O ulega rozerwaniu, w wyniku czego uporządkowana struktura kryształów zanika. Podczas ochładzania ciekłej mieszaniny następuje odtworzenie wiązań Si—O, przy czym niektóre atomy krzemu wiążą się z jonami tlenu i sodu tworząc grupy Si—O– Na+, zamiast wiązań Si—O—Si występujących w czystej krzemionce (Rys. 1) (Atkins i Jones, 2004).
Rysunek 1. Element struktury łańcucha metakrzemianu sodu.
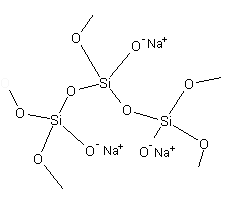
Szkło wodne jest wykorzystywane do otrzymywania polimerów krzemoorganicznych. Roztwory krzemianów metali alkalicznych mają odczyn silnie zasadowy, co sprzyja tworzeniu się łańcuchów silikonowych. W naszym doświadczeniu pod wpływem alkoholu część atomów tlenu zastała zastąpiona grupą etylową —CH2—CH3 (Polymers Slime & Superball) (Rys. 2.):
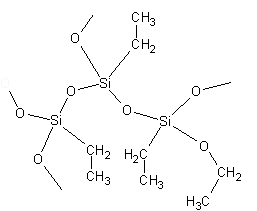
Rysunek 2. Fragment struktury polimeru silikonowego.
W zależności od rodzaju przyłączonych grup oraz warunków syntezy powstające silikony mogą być cieczami lub ciałami stałymi o różnym stopni twardości.
Uwaga substancje niebezpieczne!
Literatura:
Atkins, P. i Jones, L. (2004). Chemia ogólna. Warszawa: Wydawnictwo Naukowe PWN.
Bielański, A. (2010). Podstawy Chemii Nieorganicznej (wyd. szóste). Warszawa: PWN.
Polymers Slime & Superball: http://icn2.umeche.maine.edu/newnav/Homepage/Highschool/Slime/lecpolymers2.htm; z dnia: 18.05.2015