Artykuł opublikowany w czasopiśmie Niedziałki w 2010 roku. Udostępniono za zgodą redakcji czasopisma. Treść poprawiona i dostosowana do publikacji na stronie internetowej.
Paweł Bernard, “Szkolny eksperyment ilościowy – termochemia, część I” Niedziałki 4/2010 s. 79-86
Eksperyment chemiczny stanowi nieodzowny element kształcenia chemicznego na każdym poziomie edukacji. Jak dotąd polska podstawa programowa z chemii zarówno na poziomie gimnazjalnym jak i ponadgimnazjalnym nie zobowiązuję uczących do przedstawiania eksperymentów ilościowych. Z tego powodu nauczyciele zapoznają uczniów jedynie z eksperymentami jakościowymi, a eksperyment ilościowy jest zazwyczaj opisywany tylko teoretycznie. Trendy światowe są w tej kwestii całkowicie odmienne. Uczniowie zdający maturę międzynarodową, nie tylko są zapoznawani z metodologią eksperymentów ilościowych, ale są zobowiązani samodzielnie takie eksperymenty wykonywać podczas zajęć lekcyjnych.
W polskich programach nauczania chemiczne eksperymenty ilościowe pojawiają się sporadycznie. Jednym z takich eksperymentów jest proponowany pomiar ilości tlenu w powietrzu przez nakrycie świeczki pływającej na powierzchni wody zlewką i zmierzenie, na jaki poziom podniesie się woda. Eksperyment ten, mimo iż często daje prawidłowy wynik, budzi wiele kontrowersji. Przykładowo jak zachowa się układ, gdy zamiast jednej wprowadzimy 2 świeczki? W programie nauczania szkół ponadgimnazjalnych uczniowie mogą spotkać się z opisem techniki miareczkowania, ale nawet w tym przypadku nieczęsto nauczyciele przedstawiają tę technikę w formie pokazu, nie wspominając o samodzielnej pracy ucznia.
Dzisiejsza chemia opiera się na eksperymentach ilościowych, tymczasem na lekcjach chemii odtwarzane są doświadczenia jakościowe z XVIII – XIX wieku. Oczywiście pozwalają one kształtować umiejętności prowadzenia obserwacji i wyciągania wniosków, jednak brak eksperymentów ilościowych skutkuje tym, iż uczniowie otrzymują mylny wizerunek chemii jako nauki jak i pracy chemików zarówno w laboratoriach przemysłowych jak i naukowych. Uczniowie nie spotykają się z problemami analizy wyników liczbowych, typami i analizą błędów pomiarowych czy programami do analizy graficznej i statystycznej.
Brak eksperymentów o charakterze ilościowym jest zazwyczaj tłumaczony znacznymi kosztami urządzań pomiarowych i czasochłonnością tych eksperymentów. Tymczasem okazuje się, że odrobina kreatywności pozwala prowadzić eksperymenty ilościowe nawet w pracowni szkolnej wyposażonej w podstawowy sprzęt laboratoryjny. Poniżej przedstawiono kilka doświadczeń fizyko-chemicznych, które nie wymagają wyszukanego sprzętu, pozwalają jednak zapoznać uczniów z podstawami eksperymentów ilościowych. W tym artykule przedstawione zostaną eksperymenty obrazujące prawa i zależności z działu „Termochemia”. Doświadczenia te mogą być przedstawione przez nauczyciela w postaci pokazu, lub wykonane samodzielnie przez uczniów podczas lekcji lub zajęć koła chemicznego.
UWAGA: Przedstawione przepisy i wyniki zostały opracowane i uzyskane przez uczniów podczas zajęć lekcyjnych pod nadzorem autora. Przedstawione w przepisach wartości liczbowe (stężenia itd.) mogą, a nawet powinny być modyfikowane. Przedstawione wartości końcowe stanowią jedynie przykład, nie należy traktować ich w sposób ścisły lub jako wartości odniesienia.
Doświadczenia nr 1: Wyznaczanie rzeczywistego składu soli udowodnionej.
Odczynniki: CuSO4∙5H2O
Sprzęt: tygiel, szczypce, palnik, statyw z trójkątem ceramicznym dopasowanym do tygla, waga.
Opis wykonania: Należy wyznaczyć masę tygla wraz z pokrywką, (tygiel można wyprażyć przed ważeniem). Następnie tygiel wypełnić do około 1/3 objętości próbką soli (CuSO4∙xH2O) i zważyć. Próbkę należy wyprażyć do stałej masy, pierwsze prażenie może być dłuższe niż pozostałe np.: 10 min, kolejne po 5 min. Po każdym prażeniu należy poczekać aż tygiel ostygnie i zważyć. Zazwyczaj zmiany masy po 4 i 5 prażeniu są zaniedbywalnie małe.
Przykładowe wyniki
Tabela nr 1. Przykładowe wyniki otrzymane podczas rozkładu próbki soli CuSO4∙xH2O
|
Masa tygla z próbką [g] (±0,005 g) |
Masa próbki [g] (±0,01 g) |
Zmiana masy próbki [g] (±0,02 g) |
|
|
Przed prażeniem |
43,26 |
29,20 |
– |
|
Po prażeniu nr 1 |
36,51 |
22,45 |
-6,75 |
|
Po prażeniu nr 2 |
34,07 |
20,01 |
-2,44 |
|
Po prażeniu nr 3 |
32,54 |
18,48 |
-1,53 |
|
Po prażeniu nr 4 |
32,47 |
18,41 |
-0,07 |
Masa molowa soli bezwodnej: MCuSO4 = 159,6 g/mol
Stosunek masowy: CuSO4 do H2O → 18,41 do 10,79 g
Obliczony empiryczny stosunek molowy CuSO4 do H2O 0,115 do 0,599
W przeliczeniu na 1 mol CuSO4 → 1:5,21
Wzór rzeczywisty soli: CuSO4 ∙ 5,21H2O
Doświadczenie nr 2: Wyznaczanie temperatury krzepnięcia naftalenu.
Odczynniki: naftalen.
Sprzęt: termometr, statyw z łapą do probówek, probówka, zlewka, elektryczna płyta grzewcza lub mieszadło magnetyczne z funkcją grzania.
Opis wykonania: Probówkę do 2/3 wysokości wypełniamy naftalenem i wprowadzamy termometr. Następnie probówkę umieszczamy w łaźni wodnej. Łaźnię wodną może stanowić zlewka z gorąca wodą umieszczoną na elektrycznej płycie grzewczej. Czekamy aż cały naftalen ulegnie stopieniu. Gdy temperatura w probówce osiągnie około 90 stopni usuwamy zlewkę z gorącą wodą. Zapisujemy wskazania termometru w jednakowych odstępach czasu. (Wygląd krzywej topnienia będzie bardziej poglądowy, gdy umieścimy probówkę w chłodnym miejscu lub zlewce wypełnionej wodą o temp. około 50 °C).
Uwaga! Nie należy ogrzewać probówki z naftalenem w płomieniu palnika, ciekły naftalen jest łatwopalny!
Przykładowe wyniki: Pomiar temperatury prowadzony był w 10 sekundowych odstępach czasu. Zebrane wyniki zostały naniesione na wykres zależności temperatury od czasu (wykres nr 1).
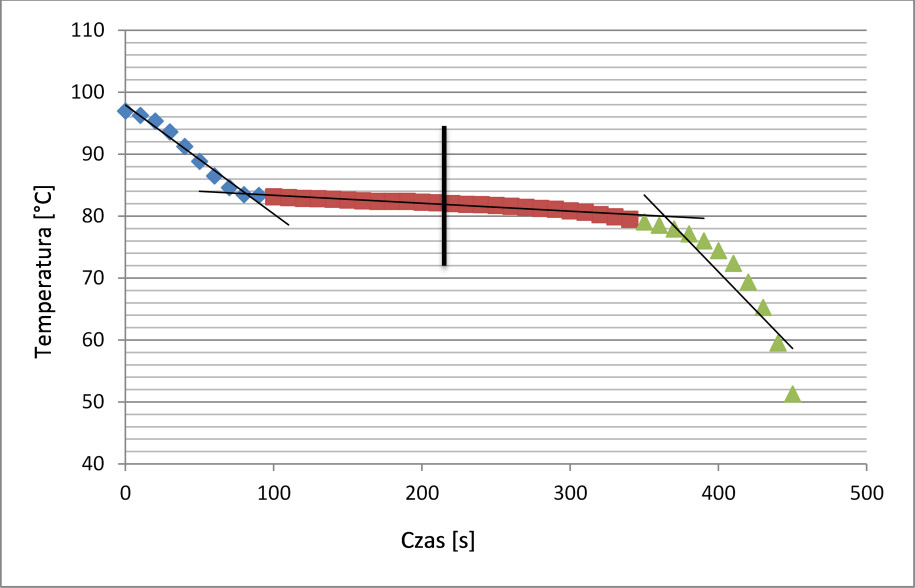
Wykres 1. Zmiany temperatury podczas chłodzenia naftalenu.
Dane na wykresie podzielono na 3 serie do których dopasowano linie proste. Dwie serie są związane z dużym gradientem temperatury, a jedna z zakresem małych zmian. Jako temperaturę topnienia (krzepnięcia) można przyjąć temperaturę w połowie długości linii trendu dopasowanej do serii danych o niewielkiej zmienności temperatur.
Wyznaczona temperatura topnienia naftalenu: 81 °C
Doświadczenie nr 3: Efekt energetyczny reakcji Zn z Cu2+.
Odczynniki: CuSO4, Zn (proszek).
Sprzęt: termometr, waga, styropianowe kubki do kawy, mieszadło magnetyczne (opcjonalnie).
Przykładowy opis wykonania: W doświadczeniu uczniowie badają efekt energetyczny towarzyszący reakcji wypierania miedzi z roztworu przez bardziej aktywny metal.
Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
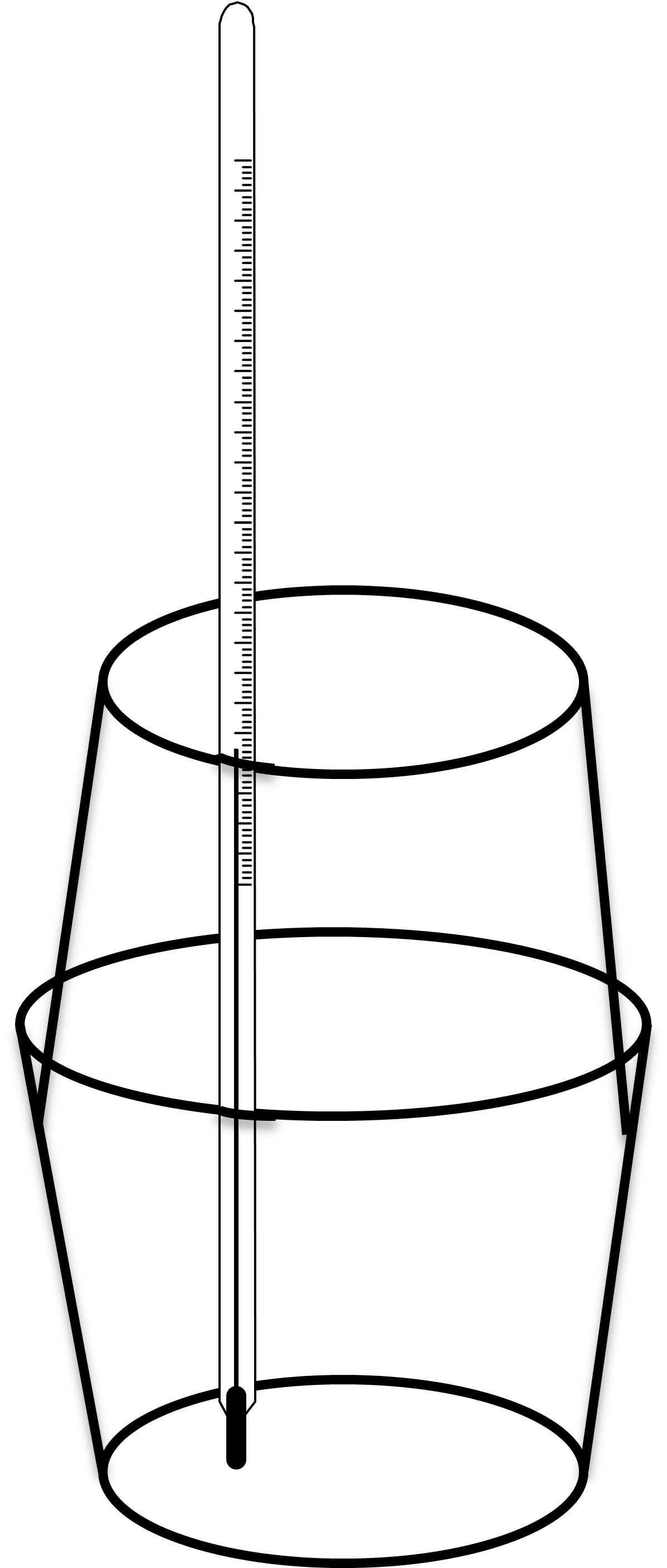
Doświadczenie opiera się na pomiarze temperatury, zatem powinno być przeprowadzone w kalorymetrze. Prosty kalorymetr można wykonać z dwóch kubków styropianowych do kawy. Jeden kubek stanowi naczynie, w którym prowadzimy reakcję, drugi należy obciąć w 2/3 wysokości, będzie on pokrywką kalorymetru. W pokrywce należy wykonać otwór, przez który wprowadzany jest termometr do naczynia (Rysunek nr 1). W naczyniu umieszczamy 25,0 cm3 roztworu soli miedzi o stężeniu 1 mol/dm3 i mierzymy temperaturę. Następnie wsypujemy około 5 g pyłu Zn. Cynk jest w nadmiarze (należy zwrócić uwagę, że zbyt duży nadmiar cynku może wpłynąć na wyniki, ze względu na dużą pojemność cieplną metalu). Zamykamy kalorymetr i mierzymy temperaturę w przyjętych wcześniej odstępach czasu. Roztwór należy mieszać poruszając całym naczyniem, lub wykorzystać mieszadło magnetyczne.
Rysunek 1. Schemat kalorymetru, w którym można przeprowadzić reakcję Zn(s) + Cu2+(aq)
Przykładowe wyniki przedstawiono na wykresie 2.
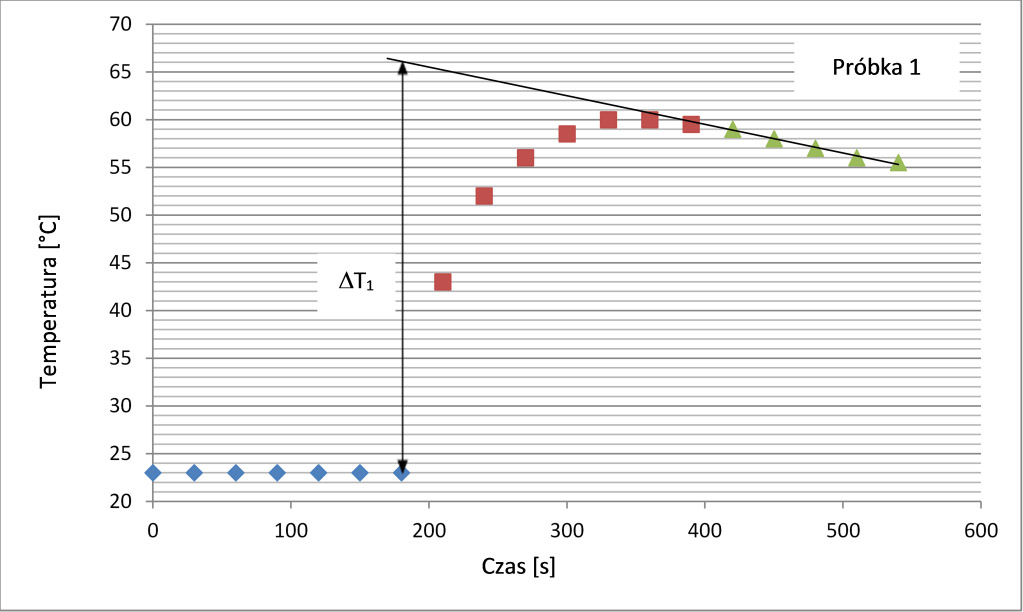
Wykres 2. Zależność temperatury względem czasu dla reakcji Zn(s) + Cu2+(aq); próbka 1.
Przyrost temperatury można wyznaczyć, jako różnicę miedzy temperaturą początkową, a temperaturą maksymalną. Jednak wartości bardziej zbliżone do literaturowych pozwala otrzymać graficzna analiza wyników, analogiczna do przedstawionej na wykresie 2. W tym przypadku zakres danych otrzymanych bezpośrednio po uzyskaniu temperatury maksymalnej potraktowano, jako osobną serie danych. Do tej serii dopasowano prostą, która została ekstrapolowana do czasu pierwszego przyrostu temperatury. Zmianę temperatury podczas procesu wyznaczono jako różnicę między temperaturą początkową, a temperaturą wskazaną przez dopasowaną prostą. Metodę tę stosuje się gdy zmiana temperatury następuje w sposób gwałtowny, a co za tym idzie początkowo pojawiają się znaczne straty ciepła (duża ilość ciepła jest absorbowana przez kalorymetr i emitowana do otoczenia). Zabieg ten przynajmniej częściowo rekompensuje początkowe straty cieplne.
Entalpię reakcji obliczamy na podstawie równania:
Q = m · c · ∆T (1)
gdzie:
m – masa wody (r-ru),
c – pojemność cieplna wody (4,18 [J∙K-1g-1]),
∆T – wyznaczona zmiana temperatury.
Można założyć, że gęstość roztworu wynosi 1 g/cm3.
Ilość ciepła pobrana przez wodę:
Q = 25,0 · 4,18 · 40,5 = 4,23 kJ
Ciepło pobrane przez wodę zostało wydzielone w trakcie reakcji. Zatem zmiana entalpii w trakcie reakcji wynosi:
∆H = -Q (2)
W doświadczeniu użyto nadmiaru cynku, zatem efekt energetyczny można odnieść do ilości moli jonów miedzi w roztworze. Użyto 25,0 cm3 roztworu o stężeniu 1 mol/dm3, więc liczba moli Cu2+ w roztworze wynosiła 0,025 mola. Po przeliczeniu na 1 mol:
∆H = -169,3 kJ/mol
Doświadczenie nr 4: Wyznaczenie entalpii reakcji hydratacji CuSO4.
Wstęp: Celem doświadczenia jest wyznaczenie entalpii reakcji:
CuSO4(s) + xH2O = CuSO4 ∙ xH2O(s)
Bezpośrednie wyznaczenie entalpii tej reakcji byłoby trudne do wykonania. Można jednak skorzystać z prawa Hessa i dojść do wyniku „inną drogą”. Skonstruowany cykl zmian entalpii przedstawiono na rysunku nr 2.
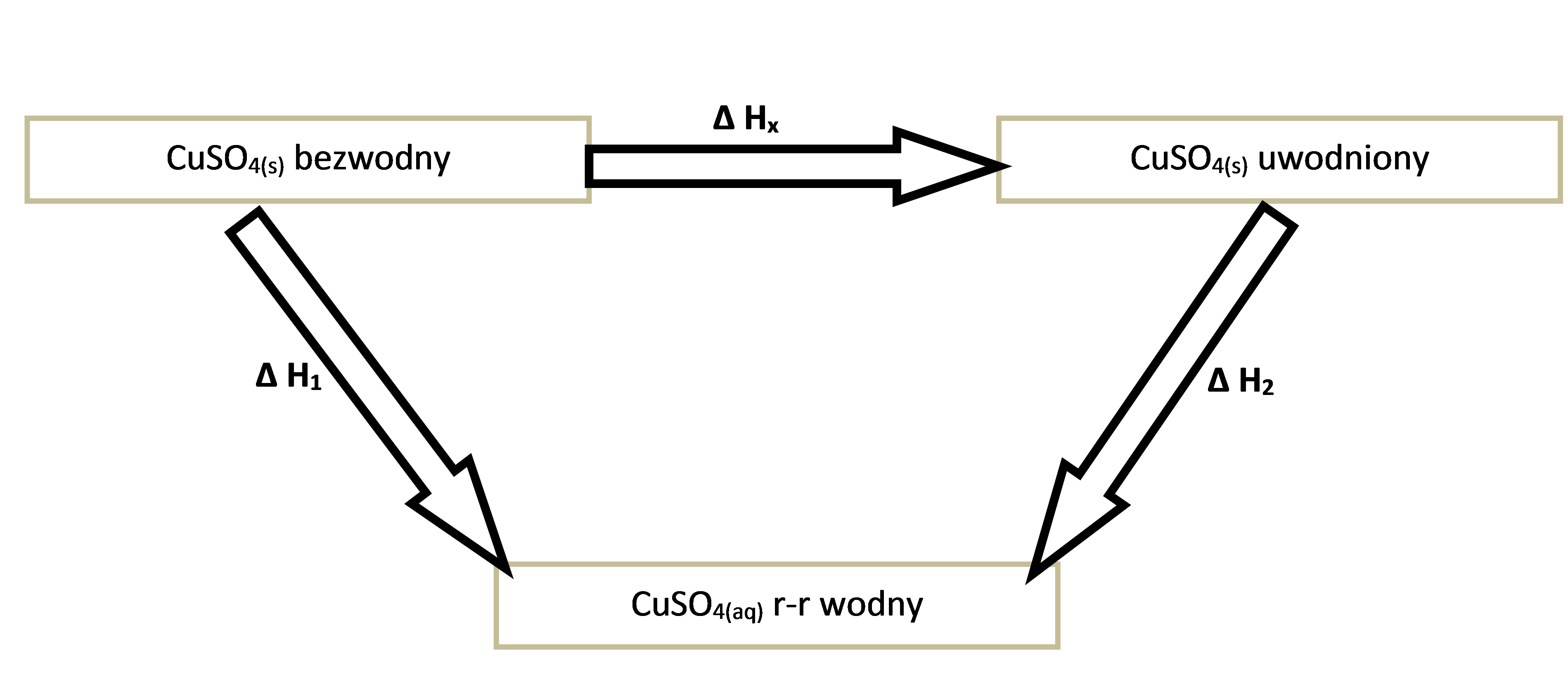
Rysunek 2. Cykl przemian pozwalający wyznaczyć entalpię reakcji hydratacji stałego siarczanu(VI) miedzi(II) w sposób niebezpośredni.
Na podstawie diagramu stwierdzamy, że entalpia szukanej reakcji może być obliczona, jako:
∆Hx = ∆H1 + (-∆H2 ) (3)
Odczynniki: CuSO4 uwodniony, CuSO4 bezwodny (można wyprażyć sól uwodnioną).
Sprzęt: termometr, waga, kubki do kawy styropianowe, mieszadło magnetyczne (opcjonalnie).
Przykładowy opis wykonania: Doświadczenie oparte jest na pomiarze efektu energetycznego towarzyszącego rozpuszczaniu soli uwodnionej i bezwodnej. Doświadczenie można wykonać w kalorymetrze opisanym w „Doświadczeniu nr 3”. W naczyniu kalorymetrycznym umieszczamy 100 g wody i mierzymy jej temperaturę. Następnie wsypujemy próbkę soli o znanej masie, około 5,5 – 6,0 g soli bezwodnej lub około 10 g soli uwodnionej. Próbkę mieszamy. Każdy z procesów należy przeprowadzać do otrzymania, co najmniej trzech zbieżnych wyników. W doświadczeniu można użyć sól bezwodną i wyznaczony stopień uwodnienia hydratu w „Doświadczeniu nr 1”.
Przykładowe wyniki
Tabela 2. Wyniki pomiaru zmian temperatury dla procesów rozpuszczania bezwodnego i uwodnionego siarczanu(VI) miedzi(II).
| CuSO4 bezwodny | ||||
|
Próbka |
Masa [g] (±0,005) |
Temp wody [°C] (±0,05) |
Tempmax r-ru [°C] (±0,05) |
∆T [°C] (±0,1) |
|
1 |
5,62 |
22,5 |
27,8 |
5,3 |
|
2 |
5,45 |
22,8 |
27,8 |
5,0 |
|
3 |
5,93 |
23,1 |
28,6 |
5,5 |
| CuSO4 ∙ 5,21H2O | ||||
|
Próbka |
Masa [g] (±0,005g) |
Temp wody [°C] (±0,05) |
Tempmax r-ru [°C] (±0,05) |
∆T [°C] (±0,1) |
|
1 |
9,81 |
23,1 |
22,1 |
-1,0 |
|
2 |
10,15 |
23,5 |
22,1 |
-1,4 |
|
3 |
10,04 |
23,1 |
22,1 |
-1,0 |
Zmianę entalpii obliczamy na podstawie równania nr 1 i 2. Na podstawie mas molowych obliczamy liczbę moli użytej substancji, a następnie przeliczamy efekt energetyczny na 1 mol (MCuSO4 = 159,62 g/mol; MCuSO4∙5,21H2O = 253,40 g/mol).
Proces rozpuszczania bezwodnego CuSO4 obserwujemy wzrost temperatury, jest to zatem proces egzotermiczny, więc entalpia tego procesu powinna przyjmować wartości ujemne, natomiast proces rozpuszczania hydratu CuSO4 jest endotermiczny, zatem zmiana entalpii musi być dodatnia.
Tabela 3. Obliczona entalpia procesów rozpuszczania bezwodnego i uwodnionego siarczanu(VI) miedzi(II).
|
Próbka |
Masa [g] (±0,005g) |
∆T [°C] (±0,1) |
Q |
Liczba moli |
Q |
Średnia ∆H |
|
|
CuSO4 bezwodny |
1 |
5,62 |
5,3 |
2199,5 |
0,035209 |
62470,5 |
-61,6 |
|
2 |
5,45 |
5,0 |
2075,0 |
0,034144 |
60772,8 |
||
|
3 |
5,93 |
5,5 |
2282,5 |
0,037151 |
61438,9 |
||
|
CuSO4 ∙ 5,21H2O |
1 |
9,81 |
-1,0 |
-415,0 |
0,038713 |
-10719,8 |
11,9 |
|
2 |
10,15 |
-1,4 |
-581,0 |
0,040055 |
-14505,0 |
||
|
3 |
10,04 |
-1,0 |
-415,0 |
0,039621 |
-10474,2 |
||
Korzystając z równania 3 obliczamy zmianę entalpii podczas procesu hydratacji bezwodnego siarczanu(VI) miedzi(II):
∆Hx = ∆H1 + (-∆H2 ) = -73,5 kJ∙mol-1
Jest to proces egzotermiczny.
Doświadczenie nr 5: Porównanie entalpii spalania wybranych alkoholi.
Wstęp: Eksperyment pozwala na wyznaczenie entalpii spalania alkoholi i innych paliw ciekłych. Ze względu na konieczność pomiaru ciepła reakcji i strat z tym związanych nie zaleca się poszukiwania konkretnej wartości dla danego paliwa, a porównanie kilku paliw i wyznaczanie trendu zmian, np. ze względu na wzrost długości łańcucha węglowego. Przebieg spalania alkoholi przedstawia ogólne równanie:
CnH2n+1OH + (3n/2)O2 = nCO2 + (n+1)H2O (4)
Podobnie jak poprzednie eksperymenty doświadczenie to opiera się na pomiarze zmian temperatury. Również do tego pomiaru można skonstruować prosty kalorymetr.
Przykład budowy kalorymetru: Główną część kalorymetru można wykonać z pudełka po butach. W pudełku należy wyciąć dwa otwory: otwór przez który wprowadzane będzie ciepło płomienia palnika (rysunek nr 3, element nr 5), oraz drugi otwór tzw. „okienko” (rysunek nr 3, element nr 2) – otwór ten będzie służył do kontroli temperatury wewnątrz kalorymetru, w otwór należy wpasować i przykleić np.: połowę szalki Petriego. Ściany pudełka należy obłożyć folią aluminiową, poprawia to izolację oraz zabezpiecza kalorymetr przed zapaleniem.
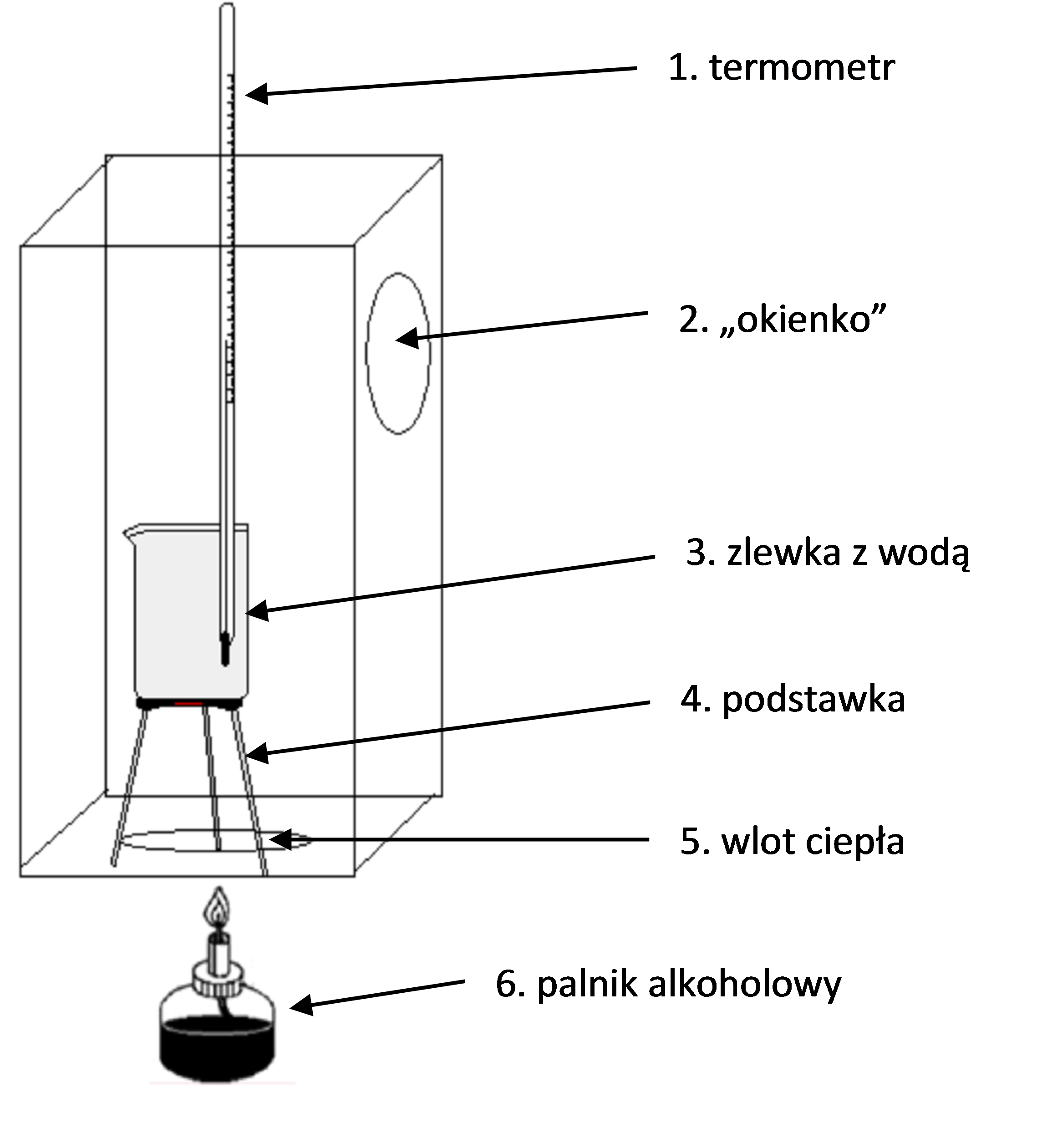
Rysunek 3. Schemat budowy kalorymetru do wyznaczania entalpii spalania paliw ciekłych.
Sprzęt: termometr, waga, palnik alkoholowy, kalorymetr (wykonany wg. rysunku nr 3)
Odczynniki: wybrane alkohole np.: etanol, propan-1-ol, butan-1-ol.
Przykładowy opis wykonania: W kalorymetrze umieszczamy zlewkę zawierającą 200 g wody i mierzymy jej temperaturę. Palnik wypełniamy badanym paliwa. Prowadzimy ogrzewanie do około 75 °C. Masę zużytego alkoholu należy wyznaczyć ważąc palnik z alkoholem przed i po ogrzewaniu. Odległość między płomieniem palnika a otworem w pudełku należy dopasować tak, aby nie zapalić pudełka i jednocześnie zminimalizować straty ciepła. Uzyskane wartości najpierw przeliczamy na 1 g, a następnie na 1 mol paliwa.
Przykładowe wyniki. W tabeli nr 4 zebrano opracowane wyniki pomiarów.
Tabela 4. Wyniki zmian temperatury związane z procesami spalania badanych alkoholi i wyznaczone na tej podstawie ciepło spalania.
|
Alkohol |
Masa zużytego alkoholu [g] (±0,0015) |
Masa wody |
∆T |
Ciepło spalania |
Ciepło spalania |
Średnie |
|
Etanol |
2,452 |
200,213 |
55 |
18772 |
865390 |
903 |
|
2,213 |
200,114 |
54 |
20411 |
940951 |
||
|
Propan-1-ol |
1,924 |
200,323 |
55 |
23937 |
1438837 |
1486 |
|
1,803 |
199,965 |
55 |
25497 |
1532653 |
||
|
Butan-1-ol |
1,779 |
200,311 |
55 |
25886 |
1919201 |
1962 |
|
1,705 |
200,529 |
55 |
27039 |
2004677 |
Na wykresie nr 3 można zaobserwować wzrost efektywności energetycznej paliw wraz ze wzrostem długości łańcucha węglowego.
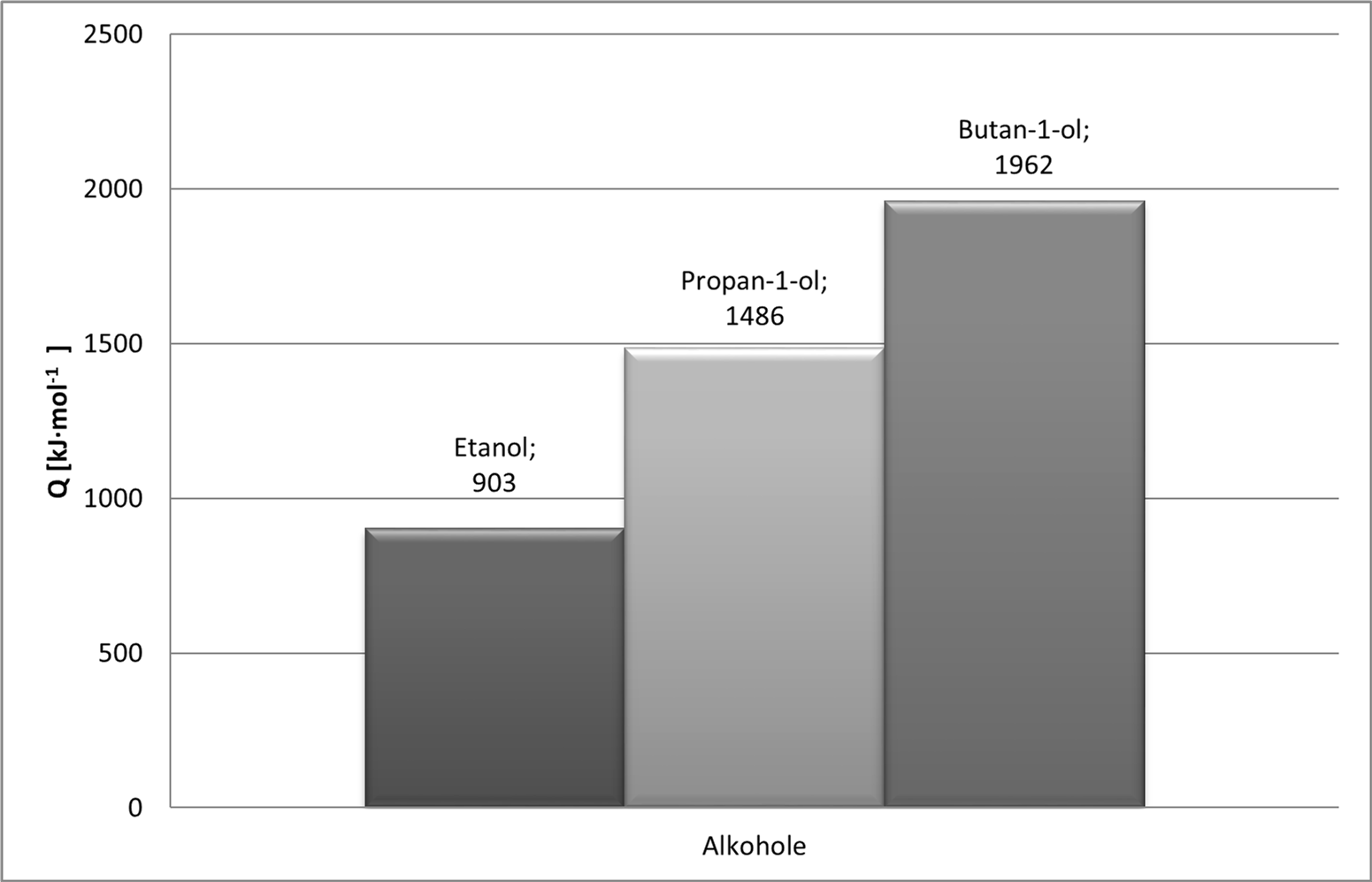
Wykres 3. Porównanie ciepła spalania wybranych alkoholi.
Podsumowanie
Przedstawione eksperymenty wykorzystują podstawowy sprzęt jakim jest termometr i waga laboratoryjna do pomiarów ilościowych. Eksperymenty te mogą być wykonywane samodzielnie przez uczniów. Ich wartość wzrośnie jeszcze bardziej, gdy nie podamy uczniom gotowego przepisu, a jedynie nakreślimy ideę pomiaru. Uczniowie samodzielnie powinni dopracować metodę, wybrać stężenia roztworów, ilości mieszanych cieczy oraz przygotować kalorymetry. Takie podejście jest zgodne z tak popularnym w ostatnim czasie nauczaniem przez odkrywanie (ang.: IBSE – Inquiry Based Science Education). Uczniowie mogą samodzielnie wybrać proces fizyczny lub chemiczny, którego efekt energetyczny chcieliby wyznaczyć, mogą do tego wykorzystać przedstawione techniki. Możemy pozwolić uczniom pobłądzić po świecie nauki, samemu zadać pytania i na nie odpowiedzieć. Dodatkowo daje nam to okazję wykazać dlaczego obliczenia chemiczne, których coraz to wyższe poziomy trudności uczniowie opanowują na kolejnych szczeblach edukacji, są tak istotne.
Literatura:
- John Green, Sadru Damji Chemistry 3rd Edition Textbook, IBID Press, 2007
- John Green, A Portfolio of Investigations for IB Chemistry, IBID Press, 2005
- Geoffrey Neuss Chemistry for the IB Diploma 2E, Oxford University Press, 2007
- Christopher Talbot Student Guide for Assessed Practical Work, IBID Press, 2006
- Chemistry Data Booklet for the first examinations 2010, Antony Rowe Ltd, Chippenham, Wiltshire, 2007