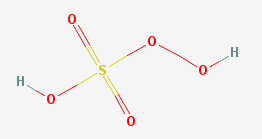
Doświadczenie przedstawione na filmie prezentuje katalityczny rozkład nadtlenku wodoru. Katalizatorem tej reakcji jest jodek potasu, a dokładnie jony jodkowe pochodzące z dysocjacji elektrolitycznej tej soli (Conklin, Kessinger, 1996). Proces ten zachodzi dwuetapowo, z udziałem produktu przejściowego – anionu jodanowego(I):
H2O2 + I– → H2O + IO–
H2O2 + IO– → H2O + O2 + I–
Sumaryczne równanie reakcji:
2H2O2 → 2H2O + O2
Dzięki obecności płynu do mycia, wydzielający się tlen tworzy pianę.
W drugiej części doświadczenia do mieszaniny dodano roztwór siarczanu(VI) miedzi(II). W wyniku tej reakcji powstaje jodek miedzi(II) (Suchow, 1984), który jest związkiem nietrwałym i rozkłada się na jodek miedzi(I) i jod (Bielański, 2010).
Cu2+ + 2I– → CuI2
2CuI2 → 2CuI + I2
Proces ten można zapisać sumarycznie:
2Cu2+ + 4I– → 2CuI + I2
Powstająca piana ma kolor brunatny pochodzący od powstającego jodku miedzi(I) oraz jodu. Dodatkowo na filmie można zaobserwować wydzielające się filetowy pary jodu. Proces rozkładu nadtlenku wodoru jest procesem egzoenergetycznym, w wysokiej temperaturze powstający jod łatwo sublimuje.
UWAGA! Substancje niebezpieczne:
Literatura:
Bielański, A. (2010). Podstawy Chemii Nieorganicznej (wyd. szóste). Warszawa: PWN.
Conklin Jr., A. R. i Kessinger, A. (1996). Demonstration of the Catalytic Decomposition of Hydrogen Peroxide. Journal of Chemical Education, 73 (9), str. 838.
Suchow, L. (1984). Simplest formula for copper iodide. Journal of Chemical Education, 61 (6), str. 566. doi:10.1021/ed061p566.2