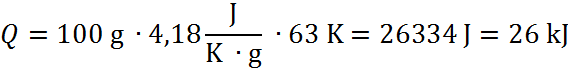Artykuł opublikowany w czasopiśmie „Chemia w szkole” w 2015 roku. Udostępniono za zgodą redakcji czasopisma.
Kinga Orwat, Paweł Bernard, Karol Dudek „O hydrolizie chlorków” Chemia w szkole 1/2015 s. 5-11
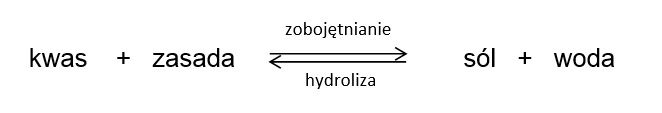
Solwolizę można opisać jako reakcję zachodzącą między substancją rozpuszczoną a cząsteczkami rozpuszczalnika lub jonami powstałymi w wyniku protonowania lub deprotonowania cząsteczek rozpuszczalnika (odpowiednio kationem lionowym lub anionem liatowym). Podczas reakcji dochodzi do zerwania jednego lub większej liczby wiązań w cząsteczkach reagującej substancji rozpuszczonej. Szczególnym przypadkiem solwolizy jest hydroliza, kiedy to funkcję rozpuszczalnika pełni woda [1].
Temat hydrolizy jest obecny w podstawie programowej na różnych poziomach edukacyjnych. Uczeń na poziomie gimnazjum:
- (…) zapisuje równanie reakcji sacharozy z wodą (za pomocą wzorów sumarycznych).
Na poziomie szkoły ponadgimnazjalnej, poziom podstawowy:
- opisuje proces zmydlania tłuszczów; zapisuje (słownie) przebieg tej reakcji.
Natomiast w szkole ponadgimnazjalnej, na poziomie rozszerzonym:
- uzasadnia (ilustrując równaniami reakcji) przyczynę kwasowego odczynu roztworów kwasów, zasadowego odczynu wodnych roztworów niektórych wodorotlenków (zasad) oraz odczynu niektórych roztworów soli (hydroliza);
- pisze równania reakcji: zobojętniania, wytrącania osadów i hydrolizy soli w formie cząsteczkowej i jonowej (pełnej i skróconej);
- wyjaśnia przebieg reakcji octanu etylu: z wodą, w środowisku o odczynie kwasowym i z roztworem wodorotlenku sodu; ilustruje je równaniami reakcji;
- zapisuje równania reakcji etyloaminy z wodą i z kwasem solnym;
- zapisuje równania reakcji acetamidu z wodą w środowisku kwasu siarkowego(VI) i z roztworem NaOH;
- (…) zapisuje równanie reakcji sacharozy z wodą (za pomocą wzorów sumarycznych);
- opisuje przebieg hydrolizy peptydów;
- zapisuje uproszczone równanie hydrolizy polisacharydów (skrobi i celulozy).
Można zauważyć, że w podstawie programowej dominują opisy procesów hydrolizy związków organicznych, a hydroliza związków nieorganicznych jest w zasadzie ograniczona do opisu hydrolizy soli. Tymczasem również wiele kowalencyjnych związków nieorganicznych także ulega procesowi hydrolizy, za przykład mogą posłużyć tu chlorki niemetali. Poniżej zestawiono opis procesów, jakim ulegają w roztworze wodnym chlorki kolejnych pierwiastków należących do trzeciego okresu układu okresowego.
Grupa 1: Chlorek sodu (NaCl) – związek ten rozpuszcza się w wodzie, ulegając rozkładowi na jony w procesie dysocjacji elektrolitycznej. Jest to sól pochodząca od mocnej zasady i mocnego kwasu, zatem hydroliza nie zachodzi, odczyn roztworu jest obojętny:
![]()
Powstające jony ulegają hydratacji, ale z uwagi na niewielki ładunek jonów nie dochodzi do istotnego zaawansowania reakcji kwasowo-zasadowych z udziałem skoordynowanych cząsteczek wody, przeciwnie do przypadków opisanych niżej.
Grupa 2: Chlorek magnezu (MgCl2) – sól ta pochodzi od kwasu chlorowodorowego i wodorotlenku magnezu. Wodorotlenek magnezu jest słabo rozpuszczalny w wodzie, jednak część rozpuszczona jest zdysocjowana praktycznie w 100%, dlatego z tego punktu widzenia jest uważany za silną zasadę. Można zapisać zatem, że w wodzie zachodzi proces dysocjacji:
![]()
Sole pochodzące od silnego kwasu i silnej zasady nie ulegają hydrolizie, odczyn ich wodnego roztworu jest obojętny. Jednakże opis ten w przypadku chlorku magnezu nie jest zgodny z obserwacjami, ponieważ jeżeli zmierzymy pH roztworu chlorku magnezu, otrzymamy wartość pH pomiędzy 5,0 – 6,0. Wytłumaczyć ten efekt można tworzeniem przez jony magnezu jonów koordynacyjnych, gdzie liczba koordynacji atomu centralnego wynosi 6 [2]. Jony te powstają w trakcie rozpuszczania MgCl2 i wykazują właściwości kwasowe.
![]()
a ich wpływ na pH roztworu wynika z ustalającej się równowagi:
![]()
Przedstawiony stan równowagi jest przesunięty w kierunku jonu heksaakwamagnezu, dlatego obserwowany odczyn jest słabo kwasowy. Należy w tym miejscu zaznaczyć, że opis chlorku magnezu jako soli niehydrolizującej, czyli jako soli, która w roztworze wodnym ulega jedynie procesowi dysocjacji jest uproszczeniem, które może być z powodzeniem stosowane na poziomie szkoły ponadgimnazjalnej.
Grupa 13: Chlorek glinu (AlCl3) w roztworze wodnym ulega procesowi dysocjacji:
![]()
Ponieważ jest to sól pochodząca od mocnego kwasu i słabej zasady, zachodzi proces hydrolizy kationowej. Zapis tego procesu możemy przedstawić jako:
![]()
Zapis ten, powszechnie stosowany w praktyce szkolnej jest prawidłowy dla roztworów stężonych, w których widoczne jest wytrącenie osadu wodorotlenku glinu. W przypadku roztworów rozcieńczonych hydrolizę kationu glinu można opisać równaniem o schemacie analogicznym do reakcji (4) [3]:
![]()
Niezależnie od tego, czy rozpatrywany jest szczegółowy przypadek roztworu stężonego czy rozcieńczonego, odczyn powstałego roztworu jest kwasowy. Większość jonów metali np. Fe3+, Cu2+, Cr3+, Al3+, Zn2+, w roztworach wodnych i w krystalicznych hydratach występuje w postaci akwakompleksów. Wodne roztwory soli tych jonów wykazują odczyn kwasowy, co spowodowane jest reakcją deprotonacji skoordynowanych cząsteczek wody (reakcje 4 i 7) [4]. W praktyce szkolnej stosuję się jednak zapis prostszy zobrazowany równaniem 6.
Grupa 14: Chlorek krzemu(IV) (SiCl4) ulega procesowi hydrolizy w wyniku, której powstaje uwodniona krzemionka i chlorowodór:
![]()
![]()
Powstający chlorowodór rozpuszcza się w wodzie i powstaje kwas chlorowodorowy.
Grupa 15: chlorki i tlenochlorki fosforu
Chlorek fosforu(III) (PCl3) – w wyniku procesu hydrolizy chlorku fosforu(III) powstaje kwas fosforowy(III) oraz chlorowodór:
![]()
Odczyn roztworu jest zatem kwasowy z powodu obecności jonów H+ pochodzących z procesów dysocjacji elektrolitycznej powstałych kwasów (część HCl(g) ulega rozpuszczeniu w wodzie).
Chlorek fosforu(V) (PCl5) – hydroliza tej substancji może przebiegać w dwojaki sposób, w zależności od temperatury:
- Na zimno – w wyniku reakcji hydrolizy chlorku fosforu(V) powstaje tlenochlorek fosforu(V) oraz chlorowodór:
![]()
Powstały tlenochlorek fosforu(V) wraz ze wzrostem temperatury układu ulega dalszemu procesowi hydrolizy [6]:
![]()
- Na gorąco: reakcja hydrolizy chlorku fosforu(V) prowadzi bezpośrednio do otrzymania kwasu fosforowego(V) oraz chlorowodoru [7]:
![]()
Odczyn roztworów w obu przypadkach jest kwasowy.
Grupa 16: Chlorki i tlenochlorki siarki
Istnieje wiele związków siarki z chlorem, które można opisać ogólnym wzorem SxCl2 (x=1-8). Najbardziej powszechne to dichlorek disiarki S2Cl2 oraz tetrachlorek siarki SCl4. Procesy hydrolizy chlorków siarki przebiegają według dość skomplikowanych schematów. Przykładowo hydroliza dichlorku disiarki prowadzi do reakcji redoks – dysproporcjonowania siarki i powstania mieszaniny produktów. W uproszczeniu proces ten można opisać równaniem reakcji:
![]()
Z kolei produktami reakcji tetrachlorku siarki SCl4 z wodą są chlorek tionylu i kwas solny:
![]()
Powstały chlorek tionylu ulega dalszej reakcji z wodą:
![]()
Można zauważyć analogię między schematem hydrolizy SCl4 i hydrolizy PCl5 na zimno.
Siarka tworzy również trwałe połączenie z chlorem i tlenem o wzorze SO2Cl2 – chlorek sulfonylu. Związek ten również ulega procesowi hydrolizy:
![]()
Grupa 17: chlor (Cl2)
Chlor pierwiastkowy jest przedostatnim pierwiastkiem trzeciego okresu. W reakcji z wodą Cl2 ulega reakcji dysproporcjonowania:
![]()
![]()
Grupa 18: Argon nie tworzy związków z chlorem.
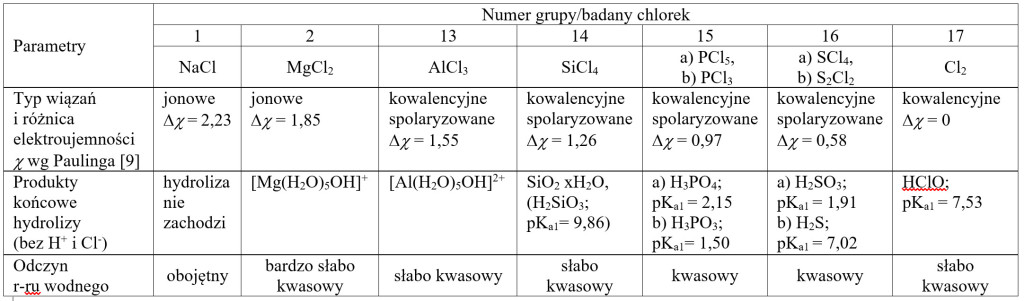
W tabeli nr 1 zestawiono produkty hydrolizy kolejnych chlorków tworzonych przez pierwiastki należące do trzeciego okresu w układzie okresowym, wraz z występującym w nich typem wiązań i produktami hydrolizy. Pierwiastki w kolejnych okresach wykazują systematyczność w zmianie charakteru chemicznego ich tlenków – od zasadowych przez amfoteryczne do kwasowych. Pewną systematyczność można zaobserwować również rozważając właściwości chlorków.
Tabela 1. Zestawienie chlorków tworzonych przez pierwiastki trzeciego okresu z produktami ich hydrolizy i wartościami pKa [9] powstających kwasów.
Procesom hydrolizy towarzyszy nie tylko zmiana pH, ale również efekty fizyczne. Przykładowo, przedmiotem badania mogą być efekty termiczne towarzyszące rozpuszczaniu i hydrolizie kolejnych chlorków.
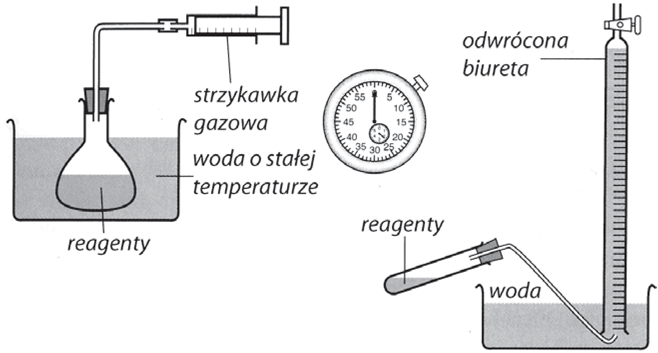
Poniżej przedstawiono przykładowy opis doświadczenia pozwalającego na wyznaczenie entalpii rozpuszczania chlorków metali trzeciego okresu wraz z przykładowym opracowaniem wyników. Doświadczenie to opiera się na pomiarze zmiany temperatury wody podczas rozpuszczania badanej substancji, powinno być zatem przeprowadzane w kalorymetrze. Prosty kalorymetr można wykonać z dwóch termicznych (styropianowych) kubków do kawy. Jeden kubek stanowi reaktor, a drugi należy obciąć w 2/3 wysokości – będzie on pokrywką kalorymetru. W pokrywce należy wykonać otwór, przez który wprowadzany jest do naczynia termometr (Rysunek 1). Podczas badania zmian temperatury w czasie procesu rozpuszczania roztwór należy mieszać poruszając całym naczyniem lub wykonać doświadczenie z wykorzystaniem mieszadła magnetycznego.
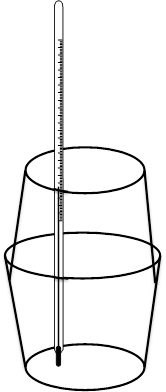
Rysunek 1. Schemat budowy kalorymetru do użytku szkolnego [10].
Ciepło reakcji można obliczyć na podstawie równania:
![]()
gdzie:
m – masa wody [g]
c – pojemność cieplna wody = 4,18 [J∙K-1g-1]
∆T – wyznaczona zmiana temperatury [K] (temperatura końcowa – temperatura początkowa)
Zmiana temperatury wody wynika z efektu cieplnego reakcji. Wykorzystanie pojemności cieplnej wody zamiast roztworu (bez uwzględniania także pojemności cieplnej kubka) stanowi przybliżenie, które nie ma jednak dużego wpływu na ostateczny rezultat.
Wartość entalpii procesu rozpuszczania wynosi:
![]()
|
Doświadczenie 5. Wyznaczanie entalpii rozpuszczania chlorku magnezu. Sprzęt i odczynniki: kalorymetr zrobiony z kubków polistyrenowych (Rysunek 2), zlewka na 150 cm3, szkiełka zegarkowe, waga, łyżeczki, termometr, stoper, nożyczki, mieszadło magnetyczne (opcjonalnie), bezwodny chlorek magnezu. Opis wykonania:
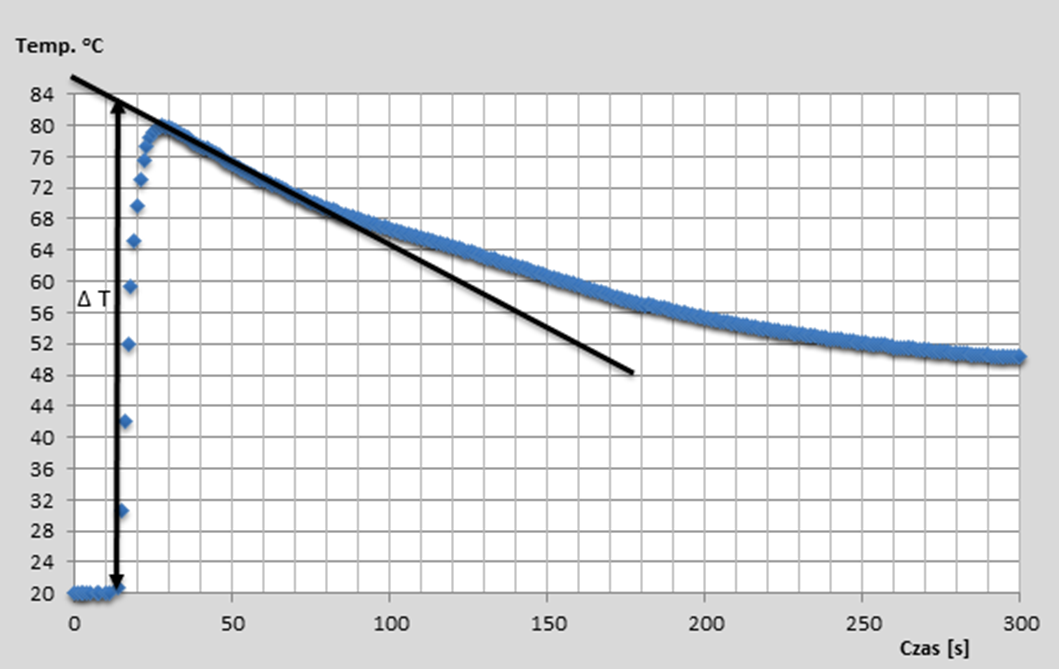
Uwaga! Doświadczenie należy wykonywać pod sprawnie działającym wyciągiem! Obserwacje: Po dodaniu chlorku magnezu do wody temperatura układu wzrosła. Przykładowe wyniki i ich opracowanie: Podczas doświadczenia zapisywana jest zależność temperatury roztworu (wody) w czasie. Błędy pomiaru temperatury wynikające z wymiany ciepła z otoczeniem pozwala zminimalizować metoda graficznej analizy wyników przedstawiona na Wykresie 1. Na otrzymaną serię danych naniesiono prostą styczną, która została ekstrapolowana do czasu zerowego, oznaczającego moment zmieszania substancji. Zmianę temperatury podczas procesu wyznaczono jako różnicę między temperaturą początkową a temperaturą wskazaną przez dopasowaną prostą dla t = 0. Metodę tę stosuje się gdy zmiana temperatury następuje w sposób gwałtowny, a co za tym idzie początkowo pojawiają się znaczne straty ciepła (duża ilość ciepła jest absorbowana przez kalorymetr i emitowana do otoczenia). Procedura ta przynajmniej częściowo rekompensuje początkowe straty ciepła. Wyniki uzyskane przez ucznia pracującego podczas lekcji pod nadzorem autora.
Wykres 1: Graficzna metoda wyznaczania zmiany temperatury podczas pomiaru. Próbka I – rozpuszczanie 9,5 g chlorku magnezu. Wykorzystując metodę przedstawiona na Wykresie 1 wyznaczono zmiany temperatur dla trzech serii danych.
Przeliczając na 1 mol MgCl2:
Wnioski: Proces rozpuszczania chlorku magnezu to proces egzotermiczny, w wyniku którego wydziela się 260 kJ/mol ciepła, tak więc entalpia rozpuszczania chlorku magnezu wynosi: -260 kJ/mol. (Wartość literaturowa: -159 kJ/mol [11].) |
Analogiczny eksperyment mnożna wykonać dla NaCl, AlCl3, itp.
Wprowadzona w 2009 roku reforma polskiego systemu oświaty wraz z opracowanymi nowymi podstawami programowymi [12] kładzie duży nacisk na wykorzystanie doświadczenia jako jednej z głównych metod nauczania, dzięki czemu uczeń zdobywa wiedzę w sposób badawczy i samodzielny. Przedstawione powyżej doświadczenia mogą być wykonywane przez uczniów według podanego przepisu – proces nauczania w formie ukierunkowanego dociekania naukowego (ang. guided inquiry) [13]. Alternatywnie nauczyciel może przedstawić uczniom jedynie metodę pomiaru i pozostawić możliwość wyboru i sformułowania pytania badawczego, hipotezy, doboru zmiennych oraz przygotowania planu postępowania eksperymentalnego. Takie podejście nazywane jest otwartym dociekaniem naukowym (ang. open inquiry) [13].
Opisane powyżej Doświadczenie 5 może być elementem eksperymentu, w którym uczeń wyznacza zależność energii sieci jonowej od, np. ładunku kationu dla chlorków metali trzeciego okresu. Energię (entalpię) sieci definiuje się jako ilość energii (entalpii), którą należy dostarczyć, by jeden mol substancji jonowej przekształcić w jony w nieskończenie dużych odległościach od siebie [5] czyli w stanie gazowym. Wartości energii i entalpii sieci różnią się o człon wynikający z pracy zmiany objętości w powyższym procesie [14]. W temperaturze pokojowej różnica ta (rzędu RT) jest niewielka i w ujęciu szkolnym można uznać równoważność tych dwóch parametrów. Takie uproszczenie zostało zastosowane w dalszej części niniejszego artykułu.
W celu teoretycznego wyznaczenia wartości entalpii sieci można wykorzystać przedstawiony na Rysunku 2 cykl termochemiczny:
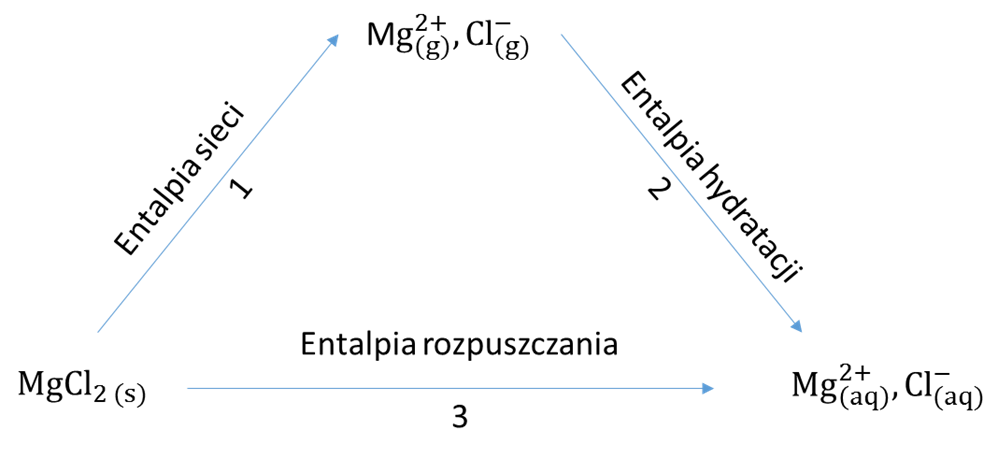
Rysunek 2. Cykl termochemiczny opisujący zależność między entalpią sieci, entalpią hydratacji i entalpią rozpuszczania dla MgCl2.
Przedstawiona na diagramie entalpia hydratacji jest definiowana jako efekt energetyczny towarzyszący wprowadzeniu jednego mola jonów określonego rodzaju z fazy gazowej do roztworu. Wartości entalpii hydratacji można znaleźć w literaturze [5]. Entalpia rozpuszczania to efekt energetyczny związany z rozpuszczeniem 1 mola danej substancji w nieskończonej ilości rozpuszczalnika. Wartości entalpii rozpuszczania mogą zostać wyznaczone eksperymentalnie, tak jak to przedstawiono w Doświadczeniu 5.
Stosując prawo Hessa i cykl termochemiczny przedstawiony na Rysunku 2, można obliczyć entalpię sieci:
Entalpia sieci = Entalpia rozpuszczania – Entalpia hydratacji
Zatem, opierając się na wynikach eksperymentu uczniowskiego pozwalającego na wyznaczenie entalpii rozpuszczania i na wartościach literaturowych entalpii hydratacji, można w łatwy sposób wyznaczyć wartość entalpii sieci krystalicznej chlorku magnezu oraz, analogicznie, dla innych chlorków trzeciego okresu.
Tabela 2. Wartości literaturowe entalpii hydratacji wybranych jonów [5]:
| Jon | ΔH hyd [kJ/mol] |
| Na+ | – 422 |
| Mg2+ | – 1954 |
| Al3+ | – 4665 |
| Cl– | – 351 |
Entalpia hydratacji danej soli stanowi sumę niezależnych od siebie entalpii hydratacji kationu i anionu z uwzględnieniem współczynników stechiometrycznych.
Obliczenie energii sieci kryształu MgCl2:

Otrzymany wynik wykazuje dobą zgodność z wartością literaturową: 2540 kJ/mol [15]
Entalpia sieci jest dodatnia, co oznacza, że proces niszczenia sieci wymaga dostarczenia energii, a proces odwrotny – tworzenia sieci związany jest zatem z uwolnieniem takiej samej ilości energii. Wartość entalpii sieci jest tym większa, im silniejsze oddziaływania występują pomiędzy jonami w krysztale. W przypadku tego samego anionu można stwierdzić, że jest ona tym większa, im większy jest ładunek kationu oraz mniejszy jego promień.
Jak widać zagadnienie hydrolizy nie ogranicza się tylko do reakcji nieorganicznych soli i niektórych związków organicznych z wodą. Temat ten jest znacznie bardziej rozbudowany, co stwarza możliwości do prezentacji wielu interesujących doświadczeń chemicznych, a nawet samodzielnej pracy eksperymentalnej uczniów. Mnogość zagadnień i obserwowanych efektów, a co za tym idzie potencjalnych problemów badawczych, które mogą stać się przedmiotem dociekania przez uczniów sprawia, że temat ten może być z powodzeniem wykorzystany przez nauczycieli którzy pragną podczas lekcji wdrożyć metodę samodzielnego dociekania wiedzy czy metodę projektów.
Literatura
[1] A. D. McNaught i A. Wilkinson, IUPAC Compendium of Chemical Terminology – Gold Book, 2 red., Oxford: Blackwell Scientific Publications, 1997.
[2] S. G. Wilkinson, R. D. Gillard i J. A. McCleverty, Comprehensive Coordination Chemistry: the Synthesis, Reactions, Properties, and Applications of Coordination Compounds, vol. 3. Main Group and Early Transition Elements, Oxford; New York; Beijing: Pergamon Press, 1989.
[3] P. Bernard, K. Orwat i K. Dudek, „O hydrolizie soli”, Chemia w Szkole, nr 6, s. 22-25, 2014.
[4] A. Reizer, Ćwiczenia z podstaw chemii i analizy jakościowej, Kraków: Wydawnictwo UJ, 1996.
[5] A. Bielański, Podstawy Chemii Nieorganicznej, szóste red., Warszawa: PWN, 2010.
[6] A. Anderson i W. R. Ashurst, „Interfacial water structure on a highly hydroxylated silica film”, Langmuir, tom 25 (19), s. 11549-54, 2009.
[7] G. I. Birley i H. A. Skinner, „Heat of hydrolysis of phosphorus pentachloride, and heat of formation of aqueous orthophosphoric acid”, Transactions of the Faraday Society, nr 64, s. 3232-3234, 1968.
[8] M. J. Carrell, „The Mechanism of the Hydrolysis of Chlorine”, Journal of the American Chemical Society, tom 68 (9), s. 1692-1694, 1946.
[9] W. Mizerski, Tablice chemiczne, Warszawa: Wydawnictwo Adamantan, 2013.
[10] P. Bernard, „Szkolny eksperyment ilościowy – termochemia, część 1”, Niedziałki, nr 4, s. 79-86, 2010.
[11] H. Jahn i G. Wolf, „The Enthalpy of Solution of MgCl2 and MgCl26H2O in Water at 25oC. The Integral Molar Enthalpy of Solution”, Journal of Solution Chemistry, tom 22(11), s. 983-994, 1993.
[12] Podstawa programowa z komentarzami. Tom 5. Edukacja przyrodnicza w szkole podstawowej, gimnazjum i liceum.
[13] P. Bernard, A. Białas, P. Broś, T. Ellermeijer, E. Kędzierska, M. Krzeczkowska, I. Maciejowska, E. Odrowąż i E. Szostak, „Podstawy metodologii IBSE”, w Nauczanie przedmiotów przyrodniczych kształtujące postawy i umiejetności badawcze uczniów. Kraków, Uniwersytet Jagielloński, 2012.
[14] J. Clark, 2013. [Online]. Available: http://www.chemguide.co.uk/physical/energetics/lattice.html.
[15] Chemistry data booklet, Cardriff, United Kingdom: International Baccalaureate Organization (UK), 2014.