Boraks to związek o wzorze sumarycznym Na2B4O7 ∙ 10H2O. Wzór ten opisuje jednak jedynie skład pierwiastkowy tej substancji, natomiast w żaden sposób nie uwzględnia jej struktury. Przyjmuje się, że bor tworzy hydroksoanion o wzorze sumarycznym [B4O5(OH)4]2- (Bailer, Emeléus, Nyholm i Trotman-Dickenson, 1973), gdzie dwa atomy boru posiadają liczbę koordynacji LK = 3, a dwa pozostałe LK = 4 (Rys. 1) (Bielański, 2010).
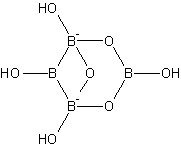
Rysunek 1. Struktura anionów tworzących boraks.
Boraks znajduje szerokie zastosowanie w przemyśle szklarskim i wykorzystywany jest do produkcji środków czyszczących. Stopiony jest używany do czyszczenia powierzchni metalicznych (Bielański, 2010).
W naszym doświadczeniu zmieszaliśmy 4% roztwór boraksu z 4% roztworem alkoholu poliwinylowego (Rys. 2). Alkohol poliwinylowy to jeden z nielicznych polimerów rozpuszczalnych się w wodzie.
![]()
Rysunek 2. Wzór półstrukturalny meru alkoholu poliwinylowego.
Rozpuszczalność alkoholu poliwinylowego w wodzie zależy od długości łańcuchów polimerowych. Parametr ten jest związany z masą cząsteczkową alkoholu, im wyższa masa tym słabsza rozpuszczalność.
Alkohol poliwinylowy wykorzystywany jest do produkcji materiałów z tworzywa sztucznego np. rękawic ochronnych, nici chirurgicznych, folii, płyt oraz rur. Ponadto jest składnikiem kropli do oczu, preparatów zapewniający odpowiednie nawilżenie rogówki i spojówek.
Pod wpływem jonów boranowych w roztworze alkoholu poliwinylowego dochodzi do sieciowania polimeru i tworzenia wiązania ─C─O─B─. Proces ten skutkuje gwałtownym wzrostem lepkości cieczy. Otrzymany polimer można z łatwością formować, jednakże pozostawiony w spoczynku rozpływa się na powierzchni (Griffen, Harrison i Shallcross, 2007).
Do mieszaniny dodano również szczyptę fluoresceiny – czerwonego, syntetycznego barwnika (Rys 3.).
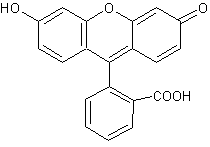
Rysunek 3. Wzór półstrukturalny fluoresceiny.
W roztworze o odczynie zasadowym, fluoresceina przyjmuje żółto-zieloną barwę. Związek ten absorbuje promieniowanie z zakresu nadfioletu i światła niebieskiego. W wyniku absorbcji promieniowania cząsteczki przechodzą do wzbudzonego stanu elektronowego. Podczas powrotu do stanu podstawowego cząsteczki fluoryzują czyli spontanicznie emitują nadmiar energii, jest to widoczne jako świecenie (Atkins, 2003).
UWAGA! Substancje niebezpieczne:
Literatura:
Atkins, P. (2003). Chemia Fizyczna (8 ed.). Warszawa: PWN.
Bailer, J. C., Emeléus, H. J., Nyholm, S., & Trotman-Dickenson, A. F. (1973). Comprehensive Inorganic Chemistry. (J. C. Bailer, Ed.) Oxford: Pergamon Press.
Bielański, A. (2010). Podstawy Chemii Nieorganicznej (szóste ed.). Warszawa: PWN.
Griffen, A., Harrison, T. i Shallcross, D. (2007). Primary circuses of experiments. Science in School(7), strony 28-32.


