Kwas benzoesowy to powszechnie stosowany środek konserwujący do żywności. Jest to kwas organiczny otrzymywany w wyniku reakcji utleniania łańcuchów bocznych alkilobenzenu (McMurry, 2007).
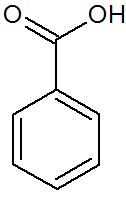
Rysunek 1. Wzór cząsteczki kwasu benzoesowego.
W warunkach normalnych jest to krystaliczne, białe ciało stałe. Temperatura topnienia kwasu benzoesowego wynosi 122,35 oC, natomiast temperatura wrzenia 249,20 oC (Haynes, 2010). Kwas ten podczas ogrzewania w temperaturze powyżej 100 oC łatwo ulega sublimacji (porównaj z: #18 Fioletowe pary jodu).
W doświadczeniu wykorzystano fakt, iż kwas benzoesowy ulega sublimacji, jak również posiada stosunkowo niską temperaturę wrzenia. Efekt zimy w kolbie można otrzymać wywołując resublimację kwasu benzoesowego. W wyniku ogrzewania pary kwasu wypełniają całą objętość naczynia naczynia. Po obniżeniu temperatury kwas krystalizuje i obserwujemy efekt przypominający padanie śniegu. Jeżeli zwiększymy ilość kwasu i intensywność sublimacji/parowania, krystalizacja zachodzi również na powierzani choinki, tworzą się kryształy kwasu w postaci podłużnych igieł.
UWAGA! Substancje niebezpieczne:
Literatura:
Haynes, W.M. (ed.) CRC Handbook of Chemistry and Physics. 91st ed. Boca Raton, FL: CRC Press Inc., 2010-2011
McMurry, J. (2007). Chemia organiczna 3. Warszawa: Wydawnictwo Naukowe PWN.


