Artykuł opublikowany w czasopiśmie „Chemia w szkole” w 2014 roku. Udostępniono za zgodą redakcji czasopisma.
Paweł Bernard, Kinga Orwat, Karol Dudek „O hydrolizie soli” Chemia w szkole 6/2014 s. 22-25
Pierwsza wzmianka o hydrolizie pojawiła się w pracy Armstronga i Millera, dotyczącej kwasów sulfonowych [1]. Hydroliza to szczególny przypadek solwolizy, czyli reakcji zachodzącej pomiędzy substancją rozpuszczoną a rozpuszczalnikiem, którym w tym przypadku jest woda [2], jeden z najczęściej stosowanych rozpuszczalników. Hydrolizie ulegają zarówno związki organiczne, jak i nieorganiczne, przy czym woda jako związek amfiprotyczny [3] może łatwo przejmować w przebiegu tych reakcji rolę kwasu lub zasady według teorii Brønsteda. Niezależnie od tego, obecność kwasu lub zasady może katalizować przebieg hydrolizy, którą wtedy określa się, odpowiednio, jako kwasową lub zasadową (przykłady tego typu procesów można znaleźć w chemii organicznej [4]). Pojawia się tu pewien problem terminologiczny, ponieważ w pracach anglojęzycznych mianem hydrolizy kwasowej (ang. acid hydrolysis) i zasadowej (ang. base hydrolysis) określane są procesy prowadzące do powstania roztworu o odczynie kwasowym lub zasadowym [5]. W tym artykule terminy „hydroliza kwasowa i zasadowa” zostaną jednak przypisane wyłącznie hydrolizie katalitycznej.
Jeśli katalizatorem jest enzym, ma miejsce hydroliza enzymatyczna, o szczególnym znaczeniu dla organizmów żywych, ponieważ procesy związane z hydrolizą ATP w komórkach pozwalają na dostarczenie im niezbędnej do życia energii [6].
Reakcję hydrolizy soli można formalnie zapisać jako reakcję odwrotną do procesu zobojętniania.
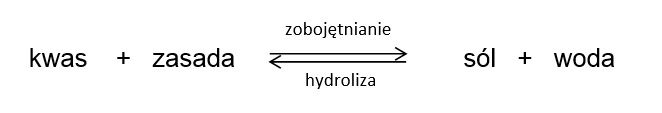
Położenie stanu równowagi tej reakcji zależne jest od stopnia dysocjacji kwasu i zasady, tworzących daną sól. Bezpośrednim skutkiem zachodzenia procesu hydrolizy w roztworach soli jest pojawienie się odpowiedniego odczynu:
- zasadowego dla soli słabych kwasów i mocnych zasad,
- kwasowego dla soli mocnych kwasów i słabych zasad [7],
- zbliżonego do obojętnego dla soli słabych kwasów i zasad,
- obojętnego dla soli mocnych kwasów i mocnych zasad, kiedy proces hydrolizy nie zachodzi.
Odczyn soli pochodzących od słabych kwasów i słabych zasad powinien być określany jako zbliżony do obojętnego, czego dobrym przykładem jest roztwór octanu amonu. Dokładne określenie odczynu roztworu konkretnej soli o danym stężeniu wymaga analizy stałych dysocjacji zaangażowanych w równowagi jonowe form kwasowych i zasadowych [8].
Przykład 1. Proces hydrolizy wodnego roztworu chlorku amonu, czyli soli pochodzącej od słabej zasady i mocnego kwasu, przebiega według równania:
![]()
Taka forma równania reakcji hydrolizy jest często określana jako „zapis jonowy skrócony” [9]. Pełny zapis jonowy:
![]()
nie jest konieczny, lecz jego użycie przypomina o zasadzie elektroobojętności układu. W wyniku tej reakcji roztwór przybiera odczyn kwasowy.
Przykład 2. Powyższy proces można uważać za jednoetapowy, ale w przypadku soli kwasów wieloprotonowych hydroliza może być wieloetapowa. Przykładowo, zjawiska zachodzące w wodnym roztworze fosforanu(V) potasu można przedstawić za pomocą następujących równań.
Podczas rozpuszczania tej soli w wodzie zachodzi najpierw proces dysocjacji elektrolitycznej kryształu:
![]()
a następnie procesowi hydrolizy ulegają jony pochodzące od względnie słabego kwasu fosforowego(V):
![]()
![]()
![]()
W wyniku ustalenia się powyższych stanów równowagi roztwór Na3PO4 uzyskuje odczyn zasadowy.
Przykład 3 – hydroliza zachodząca w roztworze chlorku cynku – soli mocnego kwasu (HCl) i słabej zasady (Zn(OH)2). W trakcie rozpuszczania sól ta ulega najpierw dysocjacji:
![]()
W ujęciu szkolnym powszechnie jest stosowany następujący zapis hydrolizy, tłumaczący powstawanie roztworu o odczynie kwasowym [9]:
![]()
Jest on jednak prawidłowy jedynie w przypadku roztworów stężonych w takim stopniu, że powstający wodorotlenek będący substancją trudno rozpuszczalną (pKS0=15,5) [10] wytrąca się w postaci osadu, co należy uściślić podając w powyższym równaniu stan skupienia Zn(OH)2. Dla roztworów tak rozcieńczonych, że osad się nie wytrąca, bardziej poprawny jest zapis, uwzględniający przykładową (jedną z wielu, ale dominującą [11]) formę akwokationu cynku:
![]()
Poniższe proste doświadczenia ilustrują hydrolizę zachodzącą w roztworze chlorku cynku i analizę jej produktów.
Przykład 4. to hydroliza węglanu sodu, soli słabego kwasu i mocnej zasady, która w trakcie rozpuszczania ulega dysocjacji na jony Na+ i CO32-:
![]()
Ponieważ aniony węglanowe pochodzą od słabego kwasu węglowego, w roztworze wodnym ulegają etapowemu procesowi hydrolizy:
![]()
![]()
W przypadku roztworów stężonych można zaobserwować wydzielanie się bezbarwnego gazu – dwutlenku węgla (tlenku węgla(IV)), będącego produktem rozkładu nietrwałego kwas węglowego, zgodnie z równaniem:
![]()
W takim przypadku sumaryczne równanie dla reakcji powyższe równania można zapisać następująco:
![]()
W konsekwencji powstający roztwór węglanu sodu wykazuje odczyn zasadowy.
Przykład 5. Rozpuszczanie i hydroliza siarczanu(IV) chromu(III), soli słabego kwasu i słabej zasady [9], przebiega zgodnie z równaniami reakcji, wskazującymi, że w tym przypadku hydroliza dotyczy zarówno kationu, jak i anionu:
![]()
Dla kationu Cr3+:
- w roztworze rozcieńczonym:
![]()
- w roztworze stężonym:
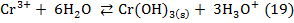
Dla anionu SO32-:
![]()
![]()
Dla teoretycznego obliczenia pH roztworu siarczanu(IV) chromu(III) o znanym stężeniu konieczna jest znajomość stałych hydrolizy. Na poziomie szkolnym można jednak po prostu przyjąć, że roztwór soli ulegającej hydrolizie kationowo-anionowej ma odczyn zbliżony do obojętnego.
Procesy hydrolizy są w praktyce wykorzystywane w chemii analitycznej (analiza jakościowa i ilościowa). Należy tu zwrócić uwagę na sole bizmutu(III), antymonu (III) i tytanu (IV), które są trwałe jedynie w silnie kwasowym środowisku. Związki te w trakcie rozcieńczania roztworów hydrolizują z utworzeniem tlenosoli lub, w przypadku tytanu, tlenku, np.:
![]() [12]
[12]
![]() [13]
[13]
![]() [14]
[14]
Hydrolizie ulegają także jony Sn2+, Sn4+, Ge4+, Pb4+, Th4+ [15] czy Fe3+ [14], z utworzeniem odpowiednich wodorotlenków.
Praktyka pokazuje, że hydroliza jest dla uczniów zagadnieniem trudnym. Należy w tym miejscu zaznaczyć, że obowiązująca podstawa programowa nauczania chemii na poziomie rozszerzonym w liceum ogólnokształcącym nie uwzględnia hydrolizy etapowej. Ponadto zapis równań hydrolizy wymaga od ucznia pewnej wiedzy na temat budowy materii i właściwości związków posiadający budowę jonową oraz cząsteczkową, reakcji kwasowo-zasadowych, mocy kwasów i zasad, a w niektórych przypadkach – także budowy związków koordynacyjnych.
Okazuje się także, że uczniowie często odnoszą opis zjawiska hydrolizy do procesu autodysocjacji wody, a więc definiują ją jako reakcję z jonami H+ lub OH– powstałymi w trakcie tego procesu. Może to prowadzić do wysnucia niepoprawnego wniosku, że hydroliza jest procesem zachodzącym w równie niewielkim stopniu, co autodysocjacja wody. Bardziej prawidłową jest interpretacja odwołująca się do amfiprotycznego charakteru cząsteczek wody [16], wskazująca, że hydroliza jest przykładem reakcji kwasowo-zasadowej. Wreszcie, omawianie zjawisk hydrolizy jest istotne dla zwrócenia uwagi uczniów na to, że woda, często postrzegana jedynie jako rozpuszczalnik, w rzeczywistości może być także ważnym reagentem w ustalających się w roztworach równowagach. [17].
Metody kształcenia możemy ogólnie podzielić na słowne, oglądowe i praktyczne [18]. Obecnie promowane są metody praktyczne, którym przypisuje się większą skuteczność i pobudzanie ciekawości ucznia względem danego tematu, a więc motywowanie do nauki. Popularnym stało się więc stosowanie tzw. aktywizacji, polegającej na samodzielnym przeprowadzaniu przez uczniów doświadczeń i rozwiązywaniu zadań problemowych [19]. Odnośnie do hydrolizy można ograniczyć część praktyczną jedynie do badania odczynów roztworów poszczególnych soli, rozbudować tę część o analizę powstałych osadów lub wydzielonych gazów (jak to pisano w doświadczeniu 1 i 2) lub wykazać jeszcze bardziej twórczy sposób postępowania. Ciekawym pomysłem może być zlecenie uczniom domowego projektu badawczego, polegającego na pieczeniu ciastek ze zmienianymi proporcjami diwodorofosforanu(V) wapnia lub wodorowęglanu sodu w ich składzie [20] i analizie wpływu tych substancji na wypieki. Przeprowadzenie takiego projektu stwarza możliwość kształcenia umiejętności projektowania eksperymentów, parametryzacji procesu badawczego, zbierania i analizy danych itp. Opanowanie tych umiejętności zostało zawarte w celach ogólnych kształcenia chemicznego na IV. etapie edukacyjnym [21], poziom rozszerzony.
Literatura:
[1] H. E. Armstrong i A. K. Miller, „Studies on sulphonic acids. No. I. On the hydrolysis of sulphonic acids and on the recovery of the benzenes from their sulphonic acids,” Journal of The Chemical Society, Transactions, nr 45, pp. 148-153, 1884.
[2] A. D. McNaught i A. Wilkinson, IUPAC Compendium of Chemical Terminology – Gold Book, 2 red., Oxford: Blackwell Scientific Publications, 1997.
[3] C. Reichardt i T. Welton, Solvents and Solvent Effects in Organic Chemistry, 4 red., Weinheim, 2011, p. 575.
[4] R. T. Morrison i R. N. Boyd, Chemia organiczna, tom 1, Warszawa: Państwowe Wydawnictwo Naukowe, 1985.
[5] N. B. Milić, „A New Meaning of the Terms „Acid Hydrolysis” and „Base Hydrolysis”,” Journal of Chemical Education, nr 61 (12), p. 1066, December 1984.
[6] P. Atkins i L. Jones, Chemia ogólna, Warszawa: Wydawnictwo Naukowe PWN, 2004.
[7] P. Atkins, Chemia Fizyczna, 8 red., Warszawa: PWN, 2003.
[8] K. Eisemann, „pH and hydrolysis of a doubly weak salt,” Journal of Chemical Education, nr 26 (11), p. 607, 1949.
[9] M. M. Poźniczek i Z. Kluz, Wybieram chemię, 1 red., Zamkor, Red.
[10] W. Mizerski, Tablice chemiczne, Warszawa: Wydawnictwo Adamantan, 2013.
[11] F. A. Cotton i G. Wilkinson, Advanced Inorganic Chemistry, 5 red., Wiley, 1988.
[12] P. Ye, J. Xie, Y. He, L. Zhang, T. Wu i Y. Wu, „Hydrolytic synthesis of flowerlike BiOCl and its photocatalytic performance under visible light,” Materials Letters, tom 108, pp. 168-171, 2013.
[13] F. C. Hentz Jr. i G. G. Long, „Synthesis, properties, and hydrolysis of antimony trichloride,” Journal of Chmical Education, nr 52 (3), p. 189, 1975.
[14] H. N. Alyea, „Hydrolysis of FeCl3. Dem. 613,” Journal of Chemical Education, nr 46 (5), p. A355, 1969.
[15] L. H. Lim, A. Bhattacharjee, B. R. Randolf i B. M. Rode, „Hydrolysis of tetravalent group IV metal ions: an ab initio simulation study,” Physical Chemistry Chemical Physics, nr 12, pp. 12423-12426, 2010.
[16] F. Aguirre-Ode, „A general approach for teaching hydrolysis of salts,” Journal of Chemical Education, nr 64 (11), p. 957, 1987.
[17] E. A. Wildman, „The need of modernizing the general course,” Journal of Chemical Education, nr 12 (1), p. 11, 1935.
[18] A. Burewicz i H. Gulińska, Dydaktyka Chemii, Poznań: Wydawnictwo Naukowe UAM, 2002.
[19] M. A. Curtin, L. R. Ingalls, A. Campbell i M. James-Pederson, „Hydrolysis Studies and Quantitative Determination of Aluminum Ions Using 27Al NMR. An Undergraduate Analytical Chemistry Experiment,” Journal of Chemical Education, nr 85 (2), p. 291, 2008.
[20] R. C. Rainey, „Making baking powder biscuits: A practical experiment on hydrolysis of salts,” Journal of Chemical Education, nr 39 (7), p. 363, 1962.
[21] Podstawa programowa z komentarzami, Tom 5, Edukacja przyrodnicza w szkole podstawowej, gimnazjum i liceum.
