„Próba Tollensa” lub inaczej „Próba lustra srebrowego” służy do wykrywania związków o właściwościach redukujących. Związkiem wykorzystywanym w tej próbie jest kation diaminasrebra(I) [Ag(NH3)2]+ utworzony w wyniku zalkalizowania roztworu azotanu(V) srebra(I) roztworem amoniaku. W pierwszym etapie powstaje brunatny osad tlenku srebra(I) (Bielański, 2010):
2Ag+ + 2OH− → Ag2O↓ + H2O
Po dodaniu nadmiaru roztworu amoniaku, osad tlenku srebra(I) ulega roztworzeniu i powstaje jon koordynacyjny (Bielański, 2010):
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+ + 2OH−
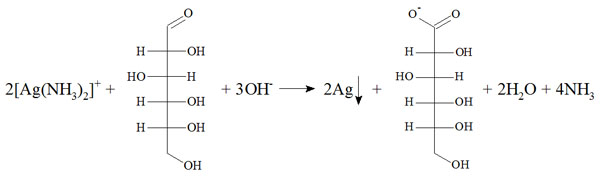
Pozytywny wynik Próby Tollensa, w postaci lustra srebrowego osadzonego na ściankach naczynia, dają związki o właściwościach redukujących zawierających w swojej strukturze najczęściej tzw. grupę aldehydową. Doświadczenie to jest również wykorzystywane do odróżnienia aldehydów od ketonów (Cotton i Wilkinson, 1988). W doświadczeniu wykorzystano glukozę, przedstawiony proces opisuje równanie:
W doświadczeniu przedstawiono także otrzymywanie lustra miedziowego. W tym przypadku zastosowanie glukozy, może prowadzić jedynie do redukcji miedzi na I stopnień utlenienia i powstania ceglastoczerwonego osadu tlenku miedzi(I). W celu redukcji i otrzymania metalicznej miedzi konieczne jest wykorzystanie bardzo silnego reduktora jakim jest hydrazyna (Rys. 1).
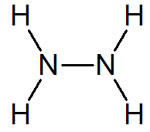 Rysunek 1. Wzór strukturalny hydrazyny.
Rysunek 1. Wzór strukturalny hydrazyny.
Cząsteczka hydrazyny zbudowana jest z dwóch połączonych ze sobą grup aminowych. Stopień utlenienia azotu w tej cząsteczce wynosi -II, co sugeruje, że może działać zarówno jako reduktor i utleniacz. Hydrazyna ma zdolność do bezprądowego redukowania metali takich jak np.: Ni, Co, Fe, Cr czy Cu (Cardulla, 1983), co wykorzystano i przedstawiono na filmie. Hydrazyna jest też stosowana jako jeden ze składników paliwa rakietowego.
Do zlewki z roztworem siarczanu(VI) miedzi(II) wprowadzono małymi porcjami hydrazynę. Proces utlenienia prowadzi do powstania azotu:
N2H4 → N2 + 4H+ + 4e–
W wyniku redukcji powstaje metaliczna miedź:
2Cu2+ + 4e– → 4Cu
Można zapisać sumaryczne równanie redoks:
2Cu2+ + N2H4 → 2Cu + N2 + 4H+
Uwaga substancje niebezpieczne! Hydrazyna jest silnie trującą i toksyczną substancją, wchłania się przez skórę i drogi oddechowe. Zatrucie hydrazyną grozi trwałymi uszkodzeniami narządów wewnętrznych. Może powodować raka.
Literatura
Bielański, A. (2010). Podstawy Chemii Nieorganicznej (wyd. szóste). Warszawa: PWN.
Cardulla, F. (1983). Hydrazine. Journal of Chemical Education, 60(6), str. 505. doi:10.1021/ed060p505
Cotton, F. A. i Wilkinson, G. (1988). Advanced Inorganic Chemistry (wyd. 5). Wiley.