Chemiluminescencja to zjawisko emisji światła w wyniku reakcji chemicznej. Najbardziej znaną substancją zdolną do emisji światła jest Luminol (rysunek 1). Związek ten w środowisku zasadowym i obecności utleniacza oraz aktywatora emituje światło o barwie niebieskiej, niebiesko-zielonej – długości fali 441-452 nm (Manna & Montpetit, 2000).
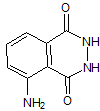
Rysunek 1. Wzór półstrukturalny luminolu (hydrazyd 3-aminoftalowy).
W środowisku zasadowym luminol zostaje przekształcony w dianion zgodnie ze schematem (Panzarasa, 2014):
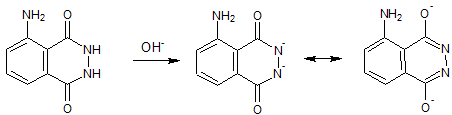
Rysunek 2. Przekształcenie luminolu w dianion.
Aktywator czyli np. jony Cu2+ lub jony Fe3+ (porównaj: #23 Wykrywanie śladów krwi) katalizują rozkład nadtlenku wodoru zgodnie z równaniem (Panzarasa, 2014), (Young, 2005):
2H2O2 → 2H2O + O2
Powstały tlen utlenia luminol. Początkowo luminol tworzy nadtlenek, a następnie odszczepione zostają atomy azotu. Końcowym produktem utlenienia jest anion dikarboksylowy (Schneider, 1970):
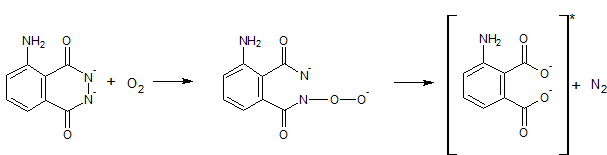
Rysunek 3. Utlenianie luminolu.
Pękające wiązania powodują wzbudzenie elektronów w atomach tlenu. Powrót do stanu podstawowego przebiega z wydzieleniem energii w postaci światła.
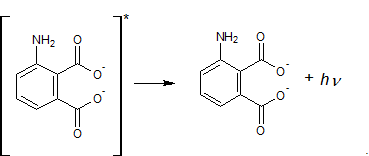
Rysunek 4. Chemiluminescencja
Czas luminescencji jest dość krótki. Widzimy, że roztwór pod koniec filmu traci intensywna niebieską barwę.
Doświadczenie wykonano według przepisu opracowanego przez Thomasa (1990).
Roztwór A otrzymuje się przez rozpuszczenie w 500 cm3 wody destylowanej:
- 2 g Na2CO3
- 0,1 g luminolu
- 12 g NaHCO3
- 0,25 g (NH4)2CO3
- 0,2 g CuSO4
Roztwór B: do 475 cm3 wody destylowanej należy dodać 25 cm3 3% roztworu H2O2
Efekt fontanny wywoływany jest w analogiczny sposób jak w doświadczeniu #13 Fontanna chlorowodorowa, jednak w tym wypadku należy użyć amoniak, ponieważ chemiluminescencja luminolu zachodzi w środowisku zasadowym. Aby wypełnić kolbę gazowym amoniakiem należy wykorzystać stężony roztwór wody amoniakalnej. Można go ogrzewać w osobnym naczyniu, tak jak to pokazano na filmie, lub bezpośrednio w kolbie. Wprowadzenie niewielkiej ilości wody do kolby z gazowym amoniakiem powoduje, że amoniak zaczyna rozpuszczać się we wprowadzonej wodzie co powoduje zmniejszenie ciśnienia w kolbie, a tym samym zassanie roztworów A i B.
UWAGA! Substancje niebezpieczne:
Literatura
Manna, A. D. i Montpetit, S., 2000. A novel approach to obtaining reliable PCR results from luminol treated bloodstains. Journal of Forensic Sciences, Tom 45(4), pp. 886-90.
Panzarasa, G., 2014. Shining Light on Nanochemistry Using Silver Nanoparticle-Enhanced Luminol Chemiluminescence. Journal of Chemical Education, Tom 91 (5), pp. 696-700.
Schneider, H. W., 1970. A new, long-lasting luminol chemiluminescent cold light. Journal of Chemical Education, Tom 47(7), p. 519.
Thomas, N. C. (1990). A chemiluminescent ammonia fountain. Journal of Chemical Education, 67 (4), str. 339. doi: 10.1021/ed067p339
Young, J. (2005). Luminol (3-Aminophthalhydrazide). Journal of Chemical Education, 82 (10), str. 1465. doi:10.1021/ed082p1465