W ramach rozgrzewki przed nowym sezonem przygotowaliśmy dla Was klip będący kompilacją opublikowanych dotychczas doświadczeń.
Jeśli się podoba bardzo prosimy o udostępnienie na Facebooku itp.
Archiwum kategorii: ciekawe doświadczenia
#30 Flubber – superlepka ciecz
Boraks to związek o wzorze sumarycznym Na2B4O7 ∙ 10H2O. Wzór ten opisuje jednak jedynie skład pierwiastkowy tej substancji, natomiast w żaden sposób nie uwzględnia jej struktury. Przyjmuje się, że bor tworzy hydroksoanion o wzorze sumarycznym [B4O5(OH)4]2- (Bailer, Emeléus, Nyholm i Trotman-Dickenson, 1973), gdzie dwa atomy boru posiadają liczbę koordynacji LK = 3, a dwa pozostałe LK = 4 (Rys. 1) (Bielański, 2010).
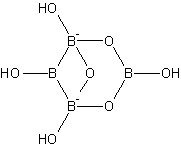
Rysunek 1. Struktura anionów tworzących boraks.
Boraks znajduje szerokie zastosowanie w przemyśle szklarskim i wykorzystywany jest do produkcji środków czyszczących. Stopiony jest używany do czyszczenia powierzchni metalicznych (Bielański, 2010).
W naszym doświadczeniu zmieszaliśmy 4% roztwór boraksu z 4% roztworem alkoholu poliwinylowego (Rys. 2). Alkohol poliwinylowy to jeden z nielicznych polimerów rozpuszczalnych się w wodzie.
![]()
Rysunek 2. Wzór półstrukturalny meru alkoholu poliwinylowego.
Rozpuszczalność alkoholu poliwinylowego w wodzie zależy od długości łańcuchów polimerowych. Parametr ten jest związany z masą cząsteczkową alkoholu, im wyższa masa tym słabsza rozpuszczalność.
Alkohol poliwinylowy wykorzystywany jest do produkcji materiałów z tworzywa sztucznego np. rękawic ochronnych, nici chirurgicznych, folii, płyt oraz rur. Ponadto jest składnikiem kropli do oczu, preparatów zapewniający odpowiednie nawilżenie rogówki i spojówek.
Pod wpływem jonów boranowych w roztworze alkoholu poliwinylowego dochodzi do sieciowania polimeru i tworzenia wiązania ─C─O─B─. Proces ten skutkuje gwałtownym wzrostem lepkości cieczy. Otrzymany polimer można z łatwością formować, jednakże pozostawiony w spoczynku rozpływa się na powierzchni (Griffen, Harrison i Shallcross, 2007).
Do mieszaniny dodano również szczyptę fluoresceiny – czerwonego, syntetycznego barwnika (Rys 3.).
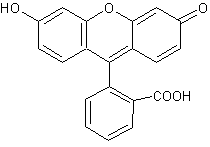
Rysunek 3. Wzór półstrukturalny fluoresceiny.
W roztworze o odczynie zasadowym, fluoresceina przyjmuje żółto-zieloną barwę. Związek ten absorbuje promieniowanie z zakresu nadfioletu i światła niebieskiego. W wyniku absorbcji promieniowania cząsteczki przechodzą do wzbudzonego stanu elektronowego. Podczas powrotu do stanu podstawowego cząsteczki fluoryzują czyli spontanicznie emitują nadmiar energii, jest to widoczne jako świecenie (Atkins, 2003).
UWAGA! Substancje niebezpieczne:
Literatura:
Atkins, P. (2003). Chemia Fizyczna (8 ed.). Warszawa: PWN.
Bailer, J. C., Emeléus, H. J., Nyholm, S., & Trotman-Dickenson, A. F. (1973). Comprehensive Inorganic Chemistry. (J. C. Bailer, Ed.) Oxford: Pergamon Press.
Bielański, A. (2010). Podstawy Chemii Nieorganicznej (szóste ed.). Warszawa: PWN.
Griffen, A., Harrison, T. i Shallcross, D. (2007). Primary circuses of experiments. Science in School(7), strony 28-32.
#29 Znikający styropian
Styren czyli fenyloeten to bezbarwna ciecz o charakterystycznym zapachu. Związek ten poddany reakcji rodnikowej polimeryzacji łańcuchowej, tworzy polistyren (McMurry, 2000) (Rys. 1):
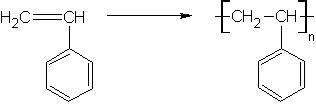
Rysunek 1. Schemat tworzenia polistyrenu.
W wyniku ogrzania w parze wodnej granulek polistyrenu otrzymuje się polistyren spieniony, który wykorzystywany jest przy produkcji pianek i styropianu.
Spieniony polistyren bardzo szybko rozpuszcza się w acetonie (propanonie), czyli popularnym rozpuszczalniku organicznym (Atkins i Jones, 2004). Podczas tego procesu dochodzi do zmiany formy polimeru: ze stałego na ciekłą. W trakcie rozpuszczania styropian staje się miękki i uwalnia pęcherzyki gazu uwięzione w piance, co obserwujemy jako pienienie się. Po odparowaniu acetonu polistyren ponownie twardnieje.
Uwaga substancje niebezpieczne!
Literatura:
Atkins, P. i Jones, L. (2004). Chemia ogólna. Warszawa: Wydawnictwo Naukowe PWN.
McMurry, J. (2000). Chemia organiczna. Warszawa: Wydawnictwo Naukowe PWN.
#28 Polimerowa piłeczka
Szkło wodne, czyli nasycony roztwór krzemianu sodu, to gęsta (syropowata) bezbarwna ciecz, którą można otrzymać w wyniku rozpuszczania stopionego SiO2 i Na2CO3. Znajduje zastosowanie jako klej mineralny, środek do impregnowania drewna, przy produkcji detergentów jak również przy produkcji żywic silikonowych (Bielański, 2010).
W podwyższonej temperaturze, podczas stapiania SiO2 i Na2CO3 wiele wiązań Si—O ulega rozerwaniu, w wyniku czego uporządkowana struktura kryształów zanika. Podczas ochładzania ciekłej mieszaniny następuje odtworzenie wiązań Si—O, przy czym niektóre atomy krzemu wiążą się z jonami tlenu i sodu tworząc grupy Si—O– Na+, zamiast wiązań Si—O—Si występujących w czystej krzemionce (Rys. 1) (Atkins i Jones, 2004).
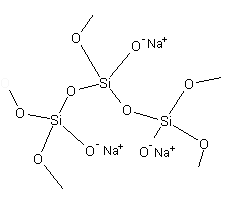
Rysunek 1. Element struktury łańcucha metakrzemianu sodu.
Szkło wodne jest wykorzystywane do otrzymywania polimerów krzemoorganicznych. Roztwory krzemianów metali alkalicznych mają odczyn silnie zasadowy, co sprzyja tworzeniu się łańcuchów silikonowych. W naszym doświadczeniu pod wpływem alkoholu część atomów tlenu zastała zastąpiona grupą etylową —CH2—CH3 (Polymers Slime & Superball) (Rys. 2.):
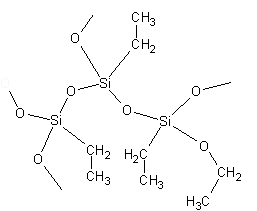
Rysunek 2. Fragment struktury polimeru silikonowego.
W zależności od rodzaju przyłączonych grup oraz warunków syntezy powstające silikony mogą być cieczami lub ciałami stałymi o różnym stopni twardości.
Uwaga substancje niebezpieczne!
Literatura:
Atkins, P. i Jones, L. (2004). Chemia ogólna. Warszawa: Wydawnictwo Naukowe PWN.
Bielański, A. (2010). Podstawy Chemii Nieorganicznej (wyd. szóste). Warszawa: PWN.
Polymers Slime & Superball: http://icn2.umeche.maine.edu/newnav/Homepage/Highschool/Slime/lecpolymers2.htm; z dnia: 18.05.2015



